
Buffertlösningar Egenskaper, beredning, exempel

De buffertlösningar eller buffertar är de som kan minska pH-förändringar på grund av H-joner3ELLER+ och OH-. I avsaknad av dessa skadas vissa system (som fysiologiska) eftersom deras komponenter är mycket känsliga för plötsliga förändringar i pH.
Precis som stötdämpare i bilar minskar påverkan som orsakas av deras rörelse, gör buffertar detsamma men med syrligheten eller basiteten i lösningen. Dessutom skapar buffertar ett specifikt pH-område inom vilket de är effektiva..

Annars är H-jonerna3ELLER+ de försurar lösningen (pH sjunker till värden under 6), vilket medför en möjlig förändring i utbytet av reaktionen. Samma exempel kan användas för grundläggande pH-värden, det vill säga större än 7.
Artikelindex
- 1 Funktioner
- 1.1 Sammansättning
- 1.2 De neutraliserar både syror och baser
- 1.3 Effektivitet
- 2 Förberedelse
- 3 Exempel
- 4 Referenser
Egenskaper
Sammansättning
De består väsentligen av en syra (HA) eller en svag bas (B) och salter av deras konjugerade bas eller syra. Följaktligen finns det två typer: syrabuffertar och alkaliska buffertar..
Syrabuffertar motsvarar HA / A-paret-, var till- är den konjugerade basen av den svaga syran HA och interagerar med joner - såsom Na+- för att bilda natriumsalter. På detta sätt förblir paret som HA / NaA, även om de också kan vara kalium- eller kalciumsalter.
Avledad från den svaga syran HA, buffrar den sura pH-intervall (mindre än 7) enligt följande ekvation:
HA + OH- => A- + HtvåELLER
Eftersom den är en svag syra hydrolyseras dess konjugatbas delvis för att regenerera en del av det konsumerade HA:
TILL- + HtvåELLER <=> HA + OH-
Å andra sidan består alkaliska buffertar av B / HB-paret+, där HB+ det är den konjugerade syran i den svaga basen. I allmänhet HB+ bildar salter med kloridjoner och lämnar paret som B / HBCl. Dessa buffertar buffrar grundläggande pH-intervall (större än 7):
B + H3ELLER+ => HB+ + HtvåELLER
Och igen, HB+ kan delvis hydrolyseras för att regenerera en del av förbrukat B:
HB+ + HtvåELLER <=> B + H3ELLER+
De neutraliserar både syror och baser
Medan sura buffertar buffrar surt pH och alkaliskt buffert basiskt pH kan båda reagera med H-joner.3ELLER+ och OH- genom dessa serier av kemiska ekvationer:
TILL- + H3ELLER+ => HA + HtvåELLER
HB+ + Åh- => B + HtvåELLER
Således, när det gäller HA / A-paret-, HA reagerar med OH-joner-, medan A- -dess konjugerade bas reagerar med H3ELLER+. När det gäller B / HB-paret+, B reagerar med H-joner3ELLER+, medan HB+ -dess konjugerade syra - med OH-.
Detta gör att båda buffertarna kan neutralisera både sura och basiska arter. Resultatet av ovanstående till exempel mot den konstanta tillsatsen av mol OH-, är minskningen av pH-variationen (ΔpH):
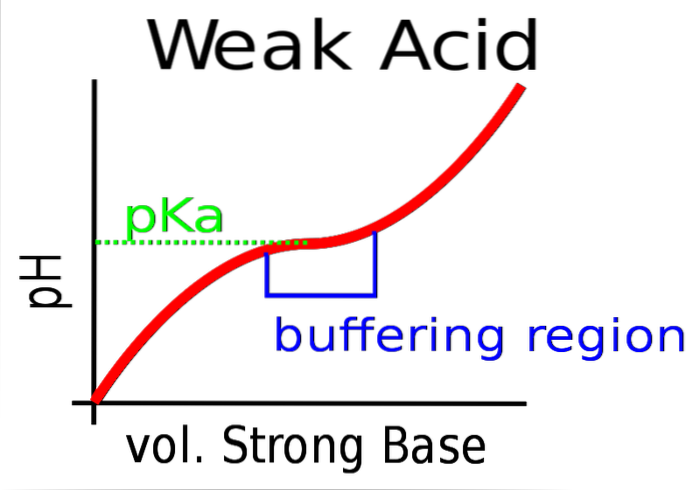
Den övre bilden visar buffringen av pH mot en stark bas (donator av OH-).
Initialt är pH surt på grund av närvaron av HA. När den starka basen tillsätts bildas de första molerna A- och bufferten börjar träda i kraft.
Det finns dock ett område av kurvan där lutningen är mindre brant; det vill säga där dämpningen är effektivare (blåaktig låda).
Effektivitet
Det finns flera sätt att förstå begreppet dämpningseffektivitet. En av dessa är att bestämma det andra derivatet av kurvan pH kontra basvolymen, lösa för V för minimivärdet, vilket är Veq / 2.
Veq är volymen vid ekvivalenspunkten; detta är basvolymen som behövs för att neutralisera all syra.
Ett annat sätt att förstå det är genom den berömda Henderson-Hasselbalch-ekvationen:
pH = pKtill + logg [[B] / [A])
Här betecknar B basen, A syran och pKtill är den minsta logaritmen för surhetskonstanten. Denna ekvation gäller både för syrasorten HA och för den konjugerade syran HB+.
Om [A] är mycket stort med avseende på [B], tar loggen () ett mycket negativt värde som subtraheras från pKtill. Om [A] å andra sidan är mycket liten med avseende på [B], får värdet på log () ett mycket positivt värde, vilket läggs till pKtill. Men när [A] = [B] är loggen () 0 och pH = pKtill.
Vad betyder alla ovanstående? Att ΔpH kommer att vara större i de ytterligheter som beaktas för ekvationen, medan det kommer att vara minimum med ett pH lika med pKtill; och som pKtill är karakteristiskt för varje syra, bestämmer detta värde pK-intervallettill± 1.
PH-värdena inom detta intervall är de där bufferten är mest effektiv..
Förberedelse
För att förbereda en buffertlösning måste du ha följande steg i åtanke:
- Vet det erforderliga pH-värdet och därför det du vill hålla så konstant som möjligt under reaktionen eller processen.
- Att känna till pH, man letar efter alla svaga syror, de vars pKtill är närmare detta värde.
- Efter att ha valt HA-arten och beräknat buffertens koncentration (beroende på hur mycket bas eller syra som behöver neutraliseras) vägs den nödvändiga mängden av dess natriumsalt..
Exempel
Ättiksyra har en pKtill av 4,75, CH3COOH; därför en blandning av vissa mängder av denna syra och natriumacetat, CH3COONa, bilda en buffert som effektivt buffrar i pH-området (3,75-5,75).
Andra exempel på monoprotiska syror är bensoesyror (C6H5COOH) och formisk (HCOOH). För var och en av dessa är deras pK-värdentill de är 4,18 och 3,68; därför är deras högsta buffrande pH-intervall (3.18-5.18) och (2.68-4.68).
Å andra sidan är polyprotiska syror såsom fosforsyra (H3PO4och kolsyra (HtvåCO3) har lika många pK-värdentill som protoner kan släppa. Således har H3PO4 har tre pKtill (2,12, 7,21 och 12,67) och HtvåCO3 har två (6 352 och 10 329).
Om du vill behålla ett pH på 3 i en lösning kan du välja mellan HCOONa / HCOOH (pKtill= 3,68) och NaHtvåPO4/ H3PO4 (pKtill= 2,12).
Den första bufferten, myrsyra, är närmare pH 3 än fosforsyrabufferten; därför buffrar HCOONa / HCOOH bättre vid pH 3 än NaHtvåPO4/ H3PO4.
Referenser
- Day, R., & Underwood, A. Kvantitativ analytisk kemi (femte upplagan). PEARSON Prentice Hall, s 188-194.
- Avsar Aras. (20 april 2013). Mini chocker. Hämtad den 9 maj 2018 från: commons.wikimedia.org
- Wikipedia. (2018). Buffert-lösning. Hämtad den 9 maj 2018 från: en.wikipedia.org
- Assoc. Prof. Lubomir Makedonski, doktor. [Dok.]. Buffertlösningar. Medicinska universitetet i Varna.
- Chem Collective. Bufferhandledning. Hämtad den 9 maj 2018 från: chemcollective.org
- askIITians. (2018). Buffert-lösning. Hämtad den 9 maj 2018 från: askiitians.com
- Quimicas.net (2018). Exempel på buffert-, buffert- eller buffertlösningar. Hämtad den 9 maj 2018 från: quimicas.net



Ingen har kommenterat den här artikeln än.