
Natriumsulfat (Na2SO4) struktur, egenskaper, användningsområden, produktion

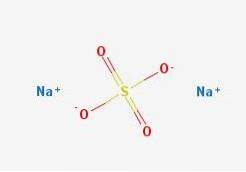
De natriumsulfat är ett oorganiskt salt vars kemiska formel är NatvåSW4. Den består av ett vitt fast ämne, närvarande i tre former: vattenfritt, heptahydrat (knappt tillgängligt) och decahydrat (som är känt som Glauberts salt); den senare är den vanligaste formen av natriumsulfat.
Natriumsulfatdekahydrat, NatvåSW410HtvåEller det upptäcktes 1625 av Glaubert i källvattnet, som kallade det sal mirabilis (mirakulöst salt) på grund av dess medicinska egenskaper.

Natriumsulfat har många tillämpningar inom textil- och pappersindustrin samt inom tillverkning av glas. Dess användningsområde utökas till termiska applikationer, som inkluderar värmeförsörjning och kylning av bärbara datorer..
Natriumsulfat är en förening med låg toxicitet och dess skadliga effekter är huvudsakligen mekaniska och icke-kemiska. Av kristallografiska skäl har detta salt, som dess kaliummotverkare, KtvåSW4, har gitter och polymorfa strukturer.
Artikelindex
- 1 Struktur
- 1.1 Vattenfritt salt
- 1.2 Dekahydrerat salt
- 2 fastigheter
- 2.1 Namn
- 2.2 Molmassa
- 2.3 Fysiskt utseende
- 2.4 Lukt
- 2.5 Smak
- 2.6 Densitet
- 2.7 Smältpunkt
- 2.8 Kokpunkt
- 2.9 Löslighet i vatten
- 2.10 Brytningsindex
- 2.11 Stabilitet
- 2.12 Sönderfall
- 2,13 pH
- 2.14 Reaktivitet
- 3 användningsområden
- 3.1 Pappersindustrin
- 3.2 Tvättmedel
- 3.3 Glasögon
- 3.4 Textilindustrin
- 3.5 Medicin
- 3.6 Torkmedel
- 3.7 Råmaterial
- 4 Skaffa
- 4.1 Utvinning av gruvdrift
- 4.2 Kemisk produktion
- 5 risker
- 6 Referenser
Strukturera
Vattenfritt salt
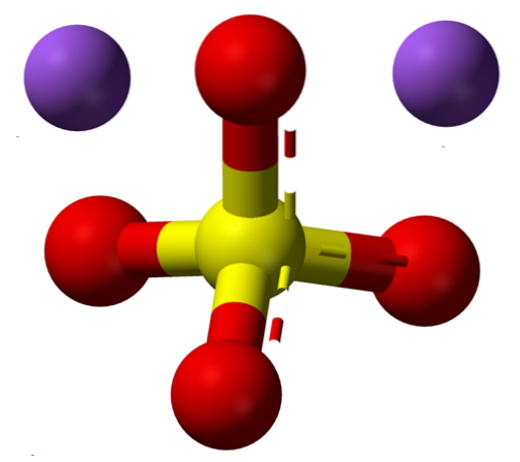
Formeln NatvåSW4 indikerar genast att Na-jonerna i saltkristallerna+ Och så4två- de har ett förhållande 1: 2; det vill säga för varannan Na-katjon+ det finns en anjon så4två- interagerar med dem genom elektrostatisk attraktion (toppbild).
Naturligtvis gäller detta för NatvåSW4 vattenfri, inga vattenmolekyler samordnade med natrium i kristallerna.
Trots att det är ett till synes enkelt salt är beskrivningen strukturellt komplex. Då entvåSW4 presenterar polymorfism med upp till fem kristallina faser: I, II, III, IV och V, vars övergångstemperatur är 180, 200, 228, 235 och 883 ºC.
Även om det inte finns några referenser för att intyga det, är NatvåSW4Jag måste vara den med en sexkantig kristallstruktur, tätare jämfört med den ortorombiska NatvåSW4III, i vars kristaller Na+ bilda tetraeder (NaO4) och oktahedra (NaO6) samordning; det vill säga det kan omges av fyra eller sex anjoner SO4två-.
Dekahydrerat salt
Under tiden har den monokliniska kristallstrukturen för dess viktigaste hydrat, NatvåSW410HtvåEller så är det enklare. I den är det praktiskt taget vattenmolekylerna som interagerar eller samordnar med Na+ i oktahedra Na (HtvåELLER)6+, med SO4två- bara ge tillräcklig stabilitet till kristallen så att den existerar i den fasta fasen.
Dess smältpunkt (32,38 ºC) är mycket lägre än det vattenfria saltet (884 ºC) visar hur vattenmolekyler och deras vätebindningar försvagar de starkare joninteraktionerna i NatvåSW4.
Egenskaper
Namn
-Natriumsulfat (IUPAC)
-Glaubersalt (dekahydrat)
-Mirakulöst salt (decahydrat)
-Dinatriumsulfat.
Molmassa
142,04 g / mol (vattenfri)
322,20 g / mol (dekahydrat)
Fysiskt utseende
Vit hygroskopisk kristallin fast substans
Odör
Toalett
Smak
Bitter och salt
Densitet
2664 g / cm3 (vattenfri)
1464 g / cm3 (dekahydrat)
Observera hur vattenmolekylerna inuti kristallerna får dem att expandera och därför minskar densiteten..
Smältpunkt
884 ºC (vattenfri)
32,38 ºC (dekahydrat)
Kokpunkt
1429 ºC (vattenfri)
Vattenlöslighet
4,76 g / 100 ml (0 ºC)
13,9 g / 100 ml (20 ° C)
42,7 g / 100 ml (100 ° C)
Alla löslighetsvärden motsvarar det vattenfria saltet, som är ganska lösligt i vatten vid alla temperaturer..
Lösligheten ökar plötsligt mellan 0 ° C och 38,34 ° C och observerar att lösligheten i detta temperaturområde ökar mer än 10 gånger. Men från 32,38 ºC är lösligheten oberoende av temperaturen..
Det händer att vid en temperatur av 32,8 ºC löses natriumsulfatdekahydratet i sitt eget kristallina vatten. En jämvikt uppnås således mellan decahydratsaltet, det vattenfria saltet och den mättade natriumsulfatlösningen..
Så länge trefasförhållandet bibehålls kommer temperaturen att förbli konstant, vilket gör att termometrarnas temperatur kan kalibreras.
Å andra sidan är lösligheterna för det heptahydrerade saltet:
19,5 g / 100 ml (0 ºC)
44,0 g / 100 ml (20 ° C)
Observera att vid 20 ° C är det heptahydrerade saltet tre gånger mer lösligt än det vattenfria..
Brytningsindex
1468 (vattenfri)
1,394 (dekahydrat)
Stabilitet
Stabil under rekommenderade lagringsförhållanden. Oförenlig med starka syror och baser, aluminium och magnesium.
Sönderfall
Vid uppvärmning till nedbrytning avger den en giftig rök av svaveloxid och natriumoxid..
pH
En 5% vattenlösning har ett pH på 7.
Reaktivitet
Natriumsulfat dissocieras i vattenlösning i 2 Na+ Och så4två-, vilket gör att sulfatjonen kan kombineras med Batvå+ för att fälla ut bariumsulfat. Hjälper praktiskt taget att förskjuta bariumjoner från vattenprover.
Natriumsulfat omvandlas till natriumsulfid genom att reagera vid förhöjda temperaturer med kol:
NatvåSW4 + 2 C => NatvåS + 2 COtvå
Glauberts salt, NaSO4.10HtvåEller reagerar med kaliumkarbonat för att producera natriumkarbonat.
Applikationer
Pappersindustrin
Natriumsulfat används vid tillverkning av pappersmassa. Det används vid produktion av kraftpapper, som inte innehåller lignin eller utsätts för blekningsprocessen, vilket ger stor motståndskraft. Dessutom används den vid tillverkning av kartong.
Tvättmedel
Används som fyllmedel för syntetiska hushållsrengöringsmedel, tillsätts i tvättmedel för att minska ytspänningen.
Glasögon
Det används vid glasframställning för att minska eller eliminera förekomsten av små luftbubblor i smält glas. Dessutom eliminerar det bildandet av slagg under raffineringen av det smälta glaset.
Textilindustrin
Natriumsulfat används som en mordant, eftersom det underlättar växelverkan mellan färgämnen och tygernas fibrer. Natriumsulfatdekahydrat används i färgämnesprovet.
Dessutom används natriumsulfat som ett färgämne utspädningsmedel och färgämne hjälpmedel; såsom direkta färgämnen, svavelfärger och andra medel som främjar bomullsfärgning. Det används också som ett fördröjningsmedel för direkta sidenfärger.
Medicin
Natriumsulfatdekahydrat används som laxermedel, eftersom det absorberas dåligt i tarmen och därför förblir i tarmens lumen vilket orsakar en volymökning. Detta stimulerar ökningen av peristaltiska sammandragningar som inducerar utvisning av tarminnehåll..
Natriumsulfat är en motgift för att kontrollera barium- och blysaltförgiftning. Glauberts salt är effektivt för eliminering av vissa för mycket intagade läkemedel; till exempel paracetamol (acetoaminophen).
Dessutom används den för att leverera bristfälliga elektrolyter som finns i isoosmotiska lösningar..
Torkmedel
Natriumsulfat, som är ett inert reagens, används för att avlägsna vatten från lösningar av organiska föreningar..
Råmaterial
Natriumsulfat används som råvara för produktion av många ämnen, inklusive: natriumsulfid, natriumkarbonat och ammoniumsulfat.
Erhållande
Natriumsulfat erhålls genom utvinning av brytning och genom kemiska reaktioner.
Gruvutvinning
Det finns tre malmer eller mineraler som utnyttjas med kommersiellt utbyte: thenardit (NatvåSW4), mirabiliten (NatvåSW410HtvåO) och glaubarit (NatvåSW4·Fall4).
I Spanien utnyttjas deponeringen av danardit och mirabilit genom underjordisk utvinning av gallerier och pelare. Under tiden erhålls glauberiten i det fria med hjälp av stora flottar som placeras på mineralavlagringen.
Marken är beredd med sprängning med låg intensitet för att producera en porositet som möjliggör utlakning av natriumsulfat. Produktionsfasen inträffar med sprinklerbevattning med glauberitens färskvatten, vars urlakning sprider sig nedåt..
Natriumsulfat-saltlösningen uppsamlas och kvarlämnar kalciumsulfatresten som fyllning..
Kemisk produktion
Natriumsulfat erhålls under produktionen av saltsyra genom två processer: Mannheim-processen och Hardgreaves-processen.
Mannheim-processen
Den utförs i stora stålugnar och med en 6 m stålreaktionsplattform. Reaktionen sker mellan natriumklorid och svavelsyra:
2 NaCl + HtvåSW4 => 2 HCl + NatvåSW4
Hardgreaves-processen
Det involverar reaktionen mellan natriumklorid, svaveloxid, syre och vatten:
4 NaCl + 2 SOtvå + ELLERtvå + 2 timmartvåO => 4 HCl + NatvåSW4
Andra
Natriumsulfat produceras i neutraliseringsreaktionen mellan natriumhydroxid och svavelsyra:
2 NaOH + HtvåSW4 => NatvåSW4 + HtvåELLER
Natriumsulfat är en biprodukt från produktionen av många föreningar. Det extraheras från det flytande avfallet som släpps ut under produktionen av viskos och cellofan. Även vid produktion av natriumdikromat, fenoler, borsyra och litiumkarbamat.
Risker
Natriumsulfat anses vara en förening med låg toxicitet. Det kan dock skada den person som använder det på fel sätt..
Det kan till exempel orsaka ögonirritation, rodnad och smärta vid kontakt. På huden kan det orsaka irritation och allergi hos vissa människor. Dess intag kan orsaka irritation i mag-tarmkanalen med illamående, kräkningar och diarré. Och slutligen producerar dess inandning irritation i luftvägarna.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Natriumsulfat. Återställd från: en.wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Natriumsulfat. PubChem-databas. CID = 24436. Återställd från: pubchem.ncbi.nlm.nih.gov
- B. N. Mehrotra. (1978). Kristallstrukturen av NatvåSW4III. Återställd från: rruff-2.geo.arizona.edu
- Glauberite-Thenardite (natriumsulfat). [PDF]. Återställd från: igme.es


Ingen har kommenterat den här artikeln än.