
Kalciumsulfid (CaS) struktur, egenskaper, produktion, användningsområden

De kalciumsulfid Det är ett oorganiskt fast ämne bildat av grundämnet kalcium (Ca) och grundämnet svavel (S), den kemiska formeln är CaS. Det är ett gulvitt fast ämne som är lösligt i vatten och finns i naturen i vissa vulkaner och i vissa meteoriter i form av ett mineral som kallas oldhamite..
När CaS löser sig i vatten bildar det olika föreningar på grund av sulfidjonen Stvå- blir jon SH- och OH-joner bildas-. Den resulterande lösningen är alkalisk. Denna förening används som bas för föreningar som är självlysande eller som producerar synligt ljus under vissa förhållanden. Dessa material används också i ljusfärger.

CaS har ansetts vara ett möjligt läkemedel för att behandla hjärt- och blodkärlsproblem såsom högt blodtryck eller högt blodtryck, vilket är en sjukdom som drabbar en stor del av världens befolkning.
Med kalciumsulfid kan andra föreningar såsom kalciumnitrat och kalciumkarbonat erhållas. Det måste hanteras med försiktighet och i kontakt med luftfuktigheten i atmosfären kan det producera HtvåS vilket är mycket giftigt.
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 Fysiska egenskaper
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Densitet
- 3.5 Löslighet
- 4 Kemiska egenskaper
- 4.1 Vattenlösning
- 4.2 Föreningar närvarande vid upplösning i vatten
- 4.3 Reaktion med syror
- 4.4 Andra reaktioner
- 5 Skaffa
- 5.1 Närvaro i naturen
- 6 användningsområden
- 6.1 I lysande material
- 6.2 Inom medicin
- 6.3 Vid erhållande av andra föreningar
- 6.4 Andra applikationer
- 7 risker
- 8 Referenser
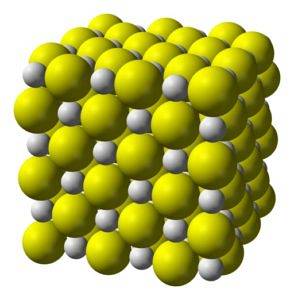
Strukturera
Kalciumsulfid är en högjonisk förening bildad av en kalciumjon Catvå+ och en sulfidjon Stvå-.
Kristalliseras till en kubisk struktur som bergsalt.
Nomenklatur
- Kalciumsulfid
Fysikaliska egenskaper
Fysiskt tillstånd
Gulvita kristallina fasta, kubiska kristaller som de av natriumklorid.
Molekylvikt
72,144 g / mol
Smältpunkt
2528 ºC
Densitet
2,59 g / cm3
Löslighet
Lösligt i vatten. Olöslig i etanol.
Kemiska egenskaper
Vattenlösning
När CaS löses upp i vatten separerar det sig i dess kalcium Ca-joner. två+ och svavel Stvå-. Det senare i vatten tar en proton och blir hydrosulfidjonen SH- frisättning av en hydroxyljon OH-.
Stvå- + HtvåO ⇔ SH- + Åh-
Därför är kalciumsulfid CaS-lösningar alkaliska (har ett grundläggande pH) och har inte S-joner.två- men SH-.
Först när en stor mängd alkali såsom natriumhydroxid NaOH tillsätts till lösningen, flyttas jämvikten mot bildandet av sulfidjoner Stvå-.

SH- kan ta ytterligare ett proton H+ från vatten och bildar vätesulfid, som är en mycket giftig förening.
SH- + HtvåO ⇔ HtvåS + OH-
Av denna anledning bildas små mängder H i vatten.tvåJa och när det utsätts för fuktighet i miljön avger CaS en obehaglig lukt som är typisk för vätesulfid.
Föreningar närvarande när de löses i vatten
Resultatet av reaktionerna i vatten som anges ovan är att Ca (SH) bildastvå, Ca (OH)två och Ca (SH) (OH).
CaS + HtvåO → Ca (SH) (OH)
Ca (SH) (OH) + HtvåO → Ca (OH)två + HtvåS
Reaktion med syror
Samma reaktioner som förekommer i vatten får CaS att reagera med syror som bildar HtvåS.
CaS + 2 HCl → CaCltvå + HtvåS
Andra reaktioner
Om en lösning av kalciumsulfid upphettas med svavel erhålls polysulfidjoner S.4två- och S3två-.
Om CaS värms upp i torr luft eller rent syre oxiderar föreningen till kalciumsulfit CaSO3 och sedan till kalciumsulfat CaSO4:
2 CaS + 3 Otvå → 2 CaSO3
2 CaSO3 + ELLERtvå → 2 CaSO4
Med oxidationsmedel såsom kaliumklorat KClO3, kaliumnitrat KNO3 eller blydioxid PbOtvå våldsamma reaktioner förekommer.
Erhållande
Kalciumsulfid kan framställas genom kalcinering (upphettning till mycket hög temperatur) av elementen kalcium (Ca) och svavel (S) i en inert atmosfär, det vill säga inget syre eller vattenånga, till exempel, är närvarande..
Ca + S + värme → CaS
Det kan också erhållas genom upphettning av kalciumsulfat CaSO4 med kol:
Fall4 + 2 C → CaS + 2 COtvå
I det senare fallet erhålls emellertid inte en ren CaS, eftersom den reagerar dessutom med CaSO4 bildar CaO och SOtvå.
CaS genereras också genom förbränning av kolavfall.
Närvaro i naturen
CaS är naturligt närvarande i mineralet oldhamite. Detta är en del av vissa meteoriter och är viktig för vetenskaplig forskning som utförs på solsystemet..
Oldhamite tros ha bildats av kondens i nebulosan som härrör från solsystemet. Det finns också i vulkaner.

Dessutom produceras kalciumsulfid naturligt genom reduktion av CaSO4 (gips) möjligen på grund av bakteriens verkan.
Applikationer
I lysande material
En av de mest utbredda användningarna av kalciumsulfid har varit som bas för självlysande föreningar. Detta är ämnen som avger synligt ljus under vissa omständigheter..
I de självlysande föreningarna av CaS fungerar detta som en bas och aktivatorer tillsätts till strukturen såsom klorider av vissa element såsom cerium (Ce).3+) och europium (Eutvå+).
Materialet som härrör från föreningen av CaS och aktivatorn används till exempel i katodstråleskärmar som utgör de gamla skärmarna på datorer eller datorer eller gamla TV-apparater.

De används också i nuvarande ljusdioder eller LED-lampor. Ljusdioder).

Dessa material används också i ljusfärger och lacker..
Inom medicin
Kalciumsulfid har i medicinska vetenskapliga studier betraktats som ett läkemedel för att behandla högt blodtryck (högt tryck i artärerna). Detta är en sjukdom som drabbar det kardiovaskulära systemet hos många människor (hjärta och blodkärl).
CaS anses vara en "givare" av HtvåS. Detta spelar en viktig roll för att reglera tonen eller styrkan i blodkärlen, så administrering av CaS kan vara ett möjligt botemedel mot hypertoni..

Vid erhållande av andra föreningar
Kalciumsulfid gör det möjligt att framställa andra föreningar såsom kalciumnitrat Ca (NO3)två:
CaS + 2 HNO3 → Ca (NO3)två + HtvåS
Det har också använts för att erhålla kalciumkarbonat CaCO3. För att göra detta utsätts en vattenlösning av CaS för kolsyrning med COtvå:
CaS + HtvåO + COtvå → HtvåS + CaCO3
Andra appar
Kalciumsulfid används också som ett smörjmedelstillsatsmedel och som ett flotationsmedel vid mineralutvinning..
Risker
Kalciumsulfid kan orsaka hud-, ögon- och luftvägsirritation. Det måste hanteras med försiktighet och med adekvat säkerhetsutrustning.
Det är en mycket giftig förening för vattenlevande liv, så det är farligt för dessa miljöer.
Referenser
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Lide, D.R. (redaktör). (2005). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Ropp, R.C. (2013). Grupp 16 (O, S, Se, Te) alkaliska jordföreningar. Kalciumsulfid. I Encyclopedia of the Alkaline Earth Compounds. Återställd från sciencedirect.com.
- Li, Y.F. et al. (2009). Kalciumsulfid (CaS), en donator av vätesulfid (H (2) S): ett nytt blodtryckssänkande läkemedel? Med Hypoteser, 2009 sep; 73 (3): 445-7. Återställd från ncbi.nlm.nih.gov.
- Hus J.E. and House, K.A. (2016). Svavel, selen och tellur. Svavel förekomst. In Descriptive Inorganic Chemistry (tredje upplagan). Återställd från sciencedirect.com.
- USA National Library of Medicine. (2019). Kalciumsulfid. Återställd från pubchem.ncbi.nlm.nih.gov.
- De Beer, M. et al. (2014). Omvandling av kalciumsulfid till kalciumkarbonat under utvinning av elementärt svavel från gipsavfall. Waste Manag, 2014 nov; 34 (11): 2373-81. Återställd från ncbi.nlm.nih.gov.


Ingen har kommenterat den här artikeln än.