
Kopparsulfidstruktur, egenskaper, användningsområden

De kopparsulfid är en familj av oorganiska föreningar vars allmänna kemiska formel är CuxSY. Ja x Det är större än Y det betyder att nämnda sulfid är rikare på koppar än svavel; och om tvärtom, x Det är mindre än Y, då är svavel rikare på svavel än koppar.
Många mineraler dominerar i naturen, vilket representerar naturliga källor till denna förening. Nästan alla är rikare på koppar än svavel, och deras sammansättning uttrycks och förenklas med formeln CuxS; här x kan till och med ta fraktionsvärden, vilket indikerar ett icke-stökiometriskt fast ämne (Cu1,75S, till exempel).

Även om svavel är gult i sitt grundläggande tillstånd verkar dess härledda föreningar mörka i färg; detta är också fallet med kopparsulfid. Mineralkoveliten (toppbilden), som huvudsakligen består av CuS, uppvisar emellertid metallisk glans och blåaktig skimning..
De kan framställas från olika källor av koppar och svavel, med användning av olika tekniker och varierande syntesparametrar. Således kan du få CuS-nanopartiklar med intressanta morfologier.
Artikelindex
- 1 Konstruktion av kopparsulfid
- 1.1 Länkar
- 1.2 Samordning i covelita
- 1.3 Andra kristaller
- 2 fastigheter
- 2.1 Allmänt
- 2.2 Covelite
- 3 användningsområden
- 3.1 Nanopartiklar inom medicin
- 3.2 Nanovetenskap
- 4 Referenser
Struktur av kopparsulfid
Länkar
Denna förening ser ut som kristallin, så man kan omedelbart tro att den är sammansatt av Cu-joner+ (monovalent koppar), Cutvå+ (tvåvärd koppar), Stvå- och inklusive Stvå- och Stvåtvå- (disulfidanjoner), som interagerar genom elektrostatiska krafter eller jonbindning.
Det finns dock en liten kovalent karaktär mellan Cu och S och därför kan Cu-S-bindningen inte uteslutas. Från detta resonemang börjar den kristallina strukturen hos CuS (och den för alla dess härledda fasta ämnen) skilja sig från de som hittats eller karakteriserats för andra joniska eller kovalenta föreningar..
Med andra ord kan vi inte tala om rena joner, men mitt i deras attraktioner (katjon-anjon) finns det en liten överlappning av deras yttre orbitaler (elektrondelning).
Koordinationer i la covelita
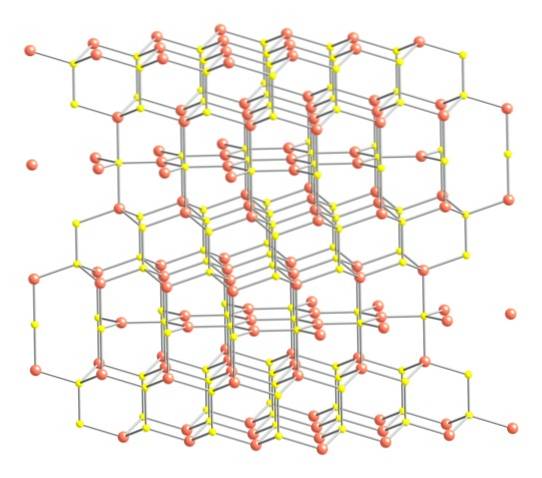
Med detta sagt, visas kristallstrukturen i coveliten i den övre bilden. Den består av sexkantiga kristaller (definierade av parametrarna för deras enhetsceller), där jonerna förenas och orienterar sig i olika koordinationer; dessa är, med ett varierat antal nära grannar.
På bilden representeras kopparjoner av rosa sfärer, medan svaveljoner representeras av gula sfärer..
Om man först fokuserar uppmärksamheten på de rosa sfärerna, kommer det att noteras att vissa är omgivna av tre gula sfärer (trigonalplankoordinering) och andra av fyra (tetrahedral koordination)..
Den första typen av koppar, trigonal, kan identifieras i planen vinkelrätt mot de sexkantiga ytorna som vetter mot läsaren, i vilka i sin tur den andra typen av kol, tetrahedral.
När vi nu vänder oss till de gula sfärerna har vissa fem rosa sfärer som grannar (trigonal bipyramidkoordinering), och andra tre och en gul sfär (återigen tetrahedral koordination); I den senare ses disulfidanjonen, som kan ses nedan och inom samma struktur av koveliten:
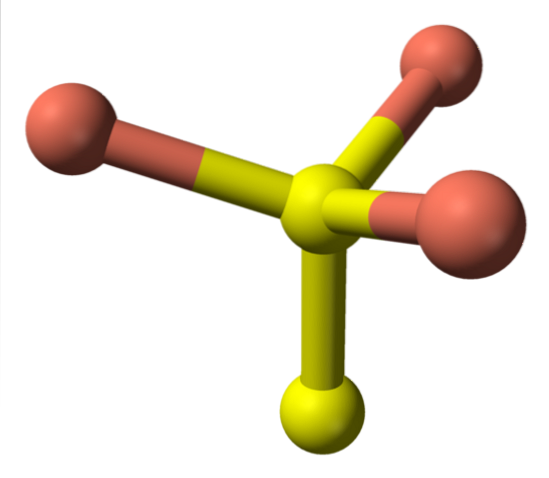
Alternativ formel
Det finns då Cu-jonertvå+, Cu+, Stvå- och Stvåtvå-. Studier utförda med röntgenfotoelektronspektroskopi (XPS) indikerar dock att all koppar är som Cu-katjoner+; och därför uttrycks den initiala formeln CuS "bättre" som (Cu+)3(S2−) (Stvå)-.
Observera att Cu: S-förhållandet för ovanstående formel fortsätter att vara 1, och dessutom avbryts avgifterna.
Andra kristaller
En kopparsulfid kan anta ortorombiska kristaller, som i polymorfen, y-CutvåS, från kalcocit; kubik, som i en annan polymorf av kalcocit, a-CutvåS; tetragonal, i mineralaniliten, Cu1,75S; monokliniker, i djurleita, Cu1,96Ja, bland andra.
För varje definierad kristall finns det ett mineral, och i sin tur har varje mineral sina egna egenskaper och egenskaper.
Egenskaper
Allmän
Egenskaperna hos kopparsulfid är föremål för Cu: S-förhållandet mellan dess fasta ämnen. Till exempel de med S-anjonertvåtvå- har sexkantiga strukturer och kan vara antingen halvledare eller metalliska ledare.
Om å andra sidan svavelhalten endast består av anjoner Stvå-, sulfider beter sig som halvledare och uppvisar också joniska konduktiviteter vid höga temperaturer. Detta beror på att dess joner börjar vibrera och röra sig inom kristallerna och därmed transportera elektriska laddningar..
Optiskt, även om det också beror på deras koppar- och svavelkomposition, kan sulfider absorbera strålning eller inte i det infraröda området av det elektromagnetiska spektrumet. Dessa optiska och elektriska egenskaper gör det möjligt för material att implementeras i olika enheter..
En annan variabel att beakta, förutom Cu: S-förhållandet, är storleken på kristallerna. Det är inte bara att det finns mer "svavel" eller "koppar" kopparsulfider, utan dimensionerna på deras kristaller ger en exakt effekt på deras egenskaper; Således är forskare angelägna om att studera och söka applikationer för Cu-nanopartiklar.xSY.
Covelite
Varje mineral eller kopparsulfid har unika egenskaper. Men av alla är kovelit det mest intressanta ur strukturell och estetisk synvinkel (på grund av dess iriserande och blå toner). Därför nämns några av dess egenskaper nedan.
Molmassa
95,611 g / mol.
Densitet
4,76 g / ml.
Smältpunkt
500 ° C; men det går sönder.
Vattenlöslighet
3.3 10-5 g / 100 ml vid 18 ° C.
Applikationer
Nanopartiklar inom medicin
Partiklarnas storlek varierar inte bara tills de når nanometriska dimensioner, men deras morfologier kan också variera kraftigt. Således kan kopparsulfid bilda nanosfärer, stavar, plattor, tunna filmer, burar, kablar eller rör..
Dessa partiklar och deras attraktiva morfologier förvärvar individuella tillämpningar inom olika medicinska områden..
Till exempel kan nanokurvar eller tomma sfärer fungera som läkemedelsbärare i kroppen. Nanosfärer har använts, stödda av kolglaselektroder och kolnanorör, för att fungera som glukosdetektorer; såväl som dess aggregat är känsliga för detektion av biomolekyler såsom DNA.
CuS-nanorör överträffar nanosfärer när det gäller att detektera glukos. Förutom dessa biomolekyler har immunsensorer designats från tunna CuS-filmer och vissa bärare för detektion av patogener..
Nanokristaller och amorfa aggregat av CuS kan till och med orsaka apoptos av cancerceller utan att skada friska celler.
Nanovetenskap
I föregående underavsnitt sägs att dess nanopartiklar har varit en del av biosensorer och elektroder. Förutom sådana användningar har forskare och tekniker också utnyttjat dess egenskaper för att designa solceller, kondensatorer, litiumbatterier och katalysatorer för mycket specifika organiska reaktioner; Oumbärliga element inom nanovetenskap.
Det är också värt att nämna att NpCuS-CA-uppsättningen (CA: Aktivt kol och Np: nanopartiklar) visade sig fungera som en avlägsnande av färgämnen som skadar människor och när den stöds på aktivt kol. vattenabsorberande oönskade molekyler.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Kopparsulfid. Återställd från: en.wikipedia.org
- Ivan Grozdanov och Metodija Najdoski. (nittonhundranittiofem). Optiska och elektriska egenskaper hos kopparsulfidfilmer med variabel sammansättning. Journal of Solid State Chemistry Volym 114, utgåva 2, 1 februari 1995, sid 469-475. doi.org/10.1006/jssc.1995.1070
- Nationellt centrum för bioteknikinformation. (2019). Kopparsulfid (CuS). PubChem-databas. CID = 14831. Återställd från: pubchem.ncbi.nlm.nih.gov
- Peter A. Ajibade och Nandipha L. Botha. (2017). Syntes, optiska och strukturella egenskaper
- av kopparsulfid-nanokristaller från enkelmolekylprekursorer. Institutionen för kemi, University of Fort Hare, Privat väska X1314, Alice 5700, Sydafrika. Nanomaterial, 7, 32.
- Samarbete: Författare och redaktörer av volymerna III / 17E-17F-41C (s.f.). Kopparsulfider (Cu2S, Cu (2-x) S) kristallstruktur, gitterparametrar. I: Madelung O., Rössler U., Schulz M. (red.) Icke-tetrahedriskt bundna element och binära föreningar I. Landolt-Börnstein-Group III Condensed Matter (Numerical Data and Functional Relationships in Science and Technology), vol 41C. Springer, Berlin, Heidelberg.
- Momtazan, F., Vafaei, A., Ghaedi, M. et al. Korean J. Chem. Eng. (2018). Tillämpning av kopparsulfid-nanopartiklar laddat aktivt kol för samtidig adsorption av ternära färgämnen: Metod för svarsytan. 35: 1108. doi.org/10.1007/s11814-018-0012-1
- Goel, S., Chen, F., & Cai, W. (2014). Syntes och biomedicinska tillämpningar av kopparsulfid-nanopartiklar: från sensorer till teranostika. Liten (Weinheim an der Bergstrasse, Tyskland), 10 (4), 631-645. doi: 10.1002 / smll.201301174



Ingen har kommenterat den här artikeln än.