
Zinksulfid (ZnS) struktur, egenskaper och användningsområden
De zinksulfid är en oorganisk förening med formeln ZnS, bildad av Zn-katjonertvå+ och S-anjonertvå-. Det finns i naturen huvudsakligen som två mineraler: wurtzite och sphalerite (eller zink blende), den senare är dess huvudsakliga form.
Sphalerite är svart till sin natur på grund av de föroreningar som den presenterar. I sin rena form har den vita kristaller, medan wurtzit har gråvita kristaller..

Zinksulfid är olösligt i vatten. Det kan orsaka miljöskador eftersom det tränger in i jorden och förorenar grundvattnet och dess strömmar.
Zinksulfid kan produceras, bland andra reaktioner, genom korrosion och genom neutralisering.
Genom korrosion:
Zn + HtvåS => ZnS + Htvå
Genom neutralisering:
HtvåS + Zn (OH)två => ZnS + 2HtvåELLER
Zinksulfid är ett fosforescerande salt som ger kapacitet för flera användningsområden och applikationer. Dessutom är det en halvledare och en fotokatalysator.
Artikelindex
- 1 Struktur
- 1.1 Zinkblandning
- 1.2 Wurzita
- 2 fastigheter
- 2.1 Färg
- 2.2 Smältpunkt
- 2.3 Löslighet i vatten
- 2.4 Löslighet
- 2.5 Densitet
- 2.6 Hårdhet
- 2.7 Stabilitet
- 2.8 Sönderfall
- 3 Nomenklatur
- 3.1 Systematiska och traditionella nomenklaturer
- 4 användningsområden
- 4.1 Som pigment eller beläggningar
- 4.2 På grund av dess fosforescens
- 4.3 Halvledare, fotokatalysator och katalysator
- 5 Referenser
Strukturera
Zinksulfid antar kristallina strukturer som styrs av elektrostatiska attraktioner mellan Zn-katjonentvå+ och anjonen Stvå-. Dessa är två: sfalerit eller zinkblende och wurzit. I båda minimerar jonerna repulsionerna mellan joner med samma laddning..
Zinkblendan är den mest stabila under de markbundna förhållandena för tryck och temperatur; och wurzit, som är mindre tät, beror på kristallin omläggning på grund av ökad temperatur.
De två strukturerna kan samexistera i samma ZnS-fasta samtidigt, även om wurziten mycket långsamt kommer att dominera..
Zink blende

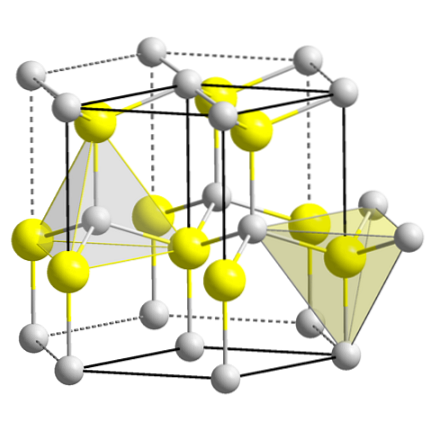
Den övre bilden visar den kubiska enhetscellen centrerad på zinkblendestrukturen. De gula sfärerna motsvarar anjonerna Stvå-, och de grå till Zn-katjonernatvå+, ligger i hörnen och i mitten av kubens ansikten.
Observera de tetraedriska geometrierna runt jonerna. Zinkblendan kan också representeras av dessa tetraeder, vars hål inuti kristallen har samma geometri (tetraedriska hål).
På samma sätt uppfylls ZnS-andelen inom enhetscellerna; det vill säga ett förhållande 1: 1. Således för varje Zn-katjontvå+ det finns en anjon Stvå-. På bilden kan det tyckas att grå sfärer finns i överflöd, men i verkligheten delas de av andra celler eftersom de är i hörnen och i mitten av kubens ansikten..
Om du till exempel tar de fyra gula sfärerna som finns inuti lådan, ska "bitarna" av alla de grå sfärerna runt den vara lika (och de gör) fyra. Således finns det i den kubiska enhetscellen fyra Zntvå+ och fyra Stvå-, uppfyller det stökiometriska förhållandet ZnS.
Det är också viktigt att betona att det finns tetraedriska hål framför och bakom de gula sfärerna (utrymmet som skiljer dem från varandra).
Wurzita
Till skillnad från zinkblendestrukturen antar wurzit ett sexkantigt kristallsystem (toppbild). Detta är mindre kompakt, så det fasta ämnet har en lägre densitet. Jonerna i wurzit har också tetrahedral omgivning och ett förhållande 1: 1 som överensstämmer med ZnS-formeln..
Egenskaper
Färg
Det kan presenteras på tre sätt:
-Wurtzite, med vita och sexkantiga kristaller.
-Sphalerite, med gråvita kristaller och kubiska kristaller.
-Som ett vitt till gråvitt eller gulaktigt pulver och kubiska gulaktiga kristaller.
Smältpunkt
1700 ° C.
Vattenlöslighet
Praktiskt taget olöslig (0,00069 g / 100 ml vid 18 ° C).
Löslighet
Olöslig i alkalier, löslig i utspädda mineralsyror.
Densitet
Sphalerit 4,04 g / cm3 och wurtzit 4,09 g / cm3.
Hårdhet
Har en hårdhet på 3 till 4 på Mohs-skalan.
Stabilitet
När det innehåller vatten oxiderar det långsamt till sulfat. I en torr miljö är den stabil.
Sönderfall
Vid uppvärmning till höga temperaturer avger den giftiga ångor av zink och svaveloxider.
Nomenklatur
Elektronkonfigurationen för Zn är [Ar] 3d104stvå. Genom att förlora de två elektronerna i 4s-omloppet förblir det som Zn-katjonentvå+ med sina d orbitaler fyllda. Därför, eftersom elektroniskt Zntvå+ det är mycket mer stabilt än Zn+, den har bara en valens på +2.
Därför utelämnas den för beståndsnomenklaturen genom att lägga till valensen i parentes och med romerska siffror: zinksulfid (II).
Systematiska och traditionella nomenklaturer
Men det finns andra sätt att ringa ZnS utöver det som redan har tagits upp. I systematik specificeras antalet atomer för varje element med de grekiska täljarna. med det enda undantaget för elementet till höger när det bara är ett. Således namnges ZnS som: apazinksulfid (och inte monozink monosulfid).
Med avseende på den traditionella nomenklaturen tillsätts zink med en enda valens på +2 genom att lägga till suffixet -ico. Följaktligen resulterar dess traditionella namn: zinksulfidico.
Applikationer
Som pigment eller beläggningar
-Sachtolith är ett vitt pigment tillverkat med zinksulfid. Används i tätningar, mastics, tätningsmedel, underrockar, latexfärger och skyltar.
Dess användning i kombination med ultraviolett ljusabsorberande pigment, såsom mikrotitan eller genomskinliga järnoxidpigment, är nödvändigt i väderbeständiga pigment..
-När ZnS appliceras på latex- eller texturerade färger har den en förlängd mikrobicid verkan.
-På grund av sin stora hårdhet och motståndskraft mot brott, erosion, regn eller damm gör den den lämplig för infraröda utomhusfönster eller i flygplansramar.
-ZnS används vid beläggning av rotorer som används vid transport av föreningar för att minska slitaget. Det används också vid tillverkning av tryckfärger, isolerande föreningar, termoplastpigmentering, flamresistent plast och elektroluminescerande lampor..
-Zinksulfid kan vara transparent och kan användas som ett fönster för synlig optik och infraröd optik. Används i mörkerseendeapparater, tv-skärmar, radarskärmar och lysrörsbeläggningar.
-ZnS med Cu-dopning används vid tillverkning av elektroluminiscenspaneler. Det används också i raketframdrivning och gravimetri.
För dess fosforescens
-Dess fosforcens används för att tona klockvisarna och därmed visa tiden i mörkret; också i färg för leksaker, i nödskyltar och trafikvarningar.
Fosforescens tillåter användning av zinksulfid i katodstrålerör och röntgenskärmar för att lysa i mörka fläckar. Färgen på fosforcens beror på vilken aktivator som används.
Halvledare, fotokatalysator och katalysator
-Sphalerite och wurtzite är bredbandsslitsade halvledare. Sphalerite har en bandspalt på 3,54 eV, medan wurtzite har en bandspalt på 3,91 eV.
-ZnS används vid beredning av en fotokatalysator bestående av CdS - ZnS / zirkonium - titanfosfat som används för väteproduktion under synligt ljus.
-Det fungerar som en katalysator för nedbrytning av organiska föroreningar. Används vid beredning av en färgsynkroniserare i LED-lampor.
-Dess nanokristaller används för ultrakänslig proteindetektering. Till exempel genom att avge ljus från kvantprickar av ZnS. Den används vid framställning av en kombinerad fotokatalysator (CdS / ZnS) -TiO2 för elektrisk produktion via fotoelektrokatalys.
Referenser
- PubChem. (2018). Zinksulfid. Hämtad från: pubchem.ncbi.nlm.nih.gov
- QuimiNet. (2015, 16 januari). Vitt pigment baserat på zinksulfid. Återställd från: quiminet.com
- Wikipedia. (2018). Zinksulfid. Hämtad från: en.wikipedia.org
- II-VI UK. (2015). Zinksulfid (ZnS). Hämtad från: ii-vi.es
- Rob Toreki. (2015, 30 mars). Zinkblende (ZnS) -strukturen. Hämtad från: ilpi.com
- Kemi LibreTexts. (22 januari 2017). Structure-Zink Blende (ZnS). Hämtad från: chem.libretexts.org
- Läs igen. (2018). Zinksulfid / Zinksulfid (ZnS). Hämtad från: reade.com



Ingen har kommenterat den här artikeln än.