
Faust teknik grund och material, steg, fördelar, nackdelar
De Faust-teknik Det är en metod som möjliggör koncentrationen av vissa parasitägg och / eller larver som ingår i avföringen genom flytning. Den används när direkta avföringsprov är negativa eller när du vill få rena prover utan detritus.
Koncentrationsmetoder för samproparasitologiska undersökningar är av tre typer: genom flotation, genom sedimentering eller genom metoder som kombinerar de två föregående. Dessa metoder ökar risken för positiva resultat.

Faust-metoden består av att blanda en del av avföringsprovet med ett ämne som är tätare än äggen eller parasiterna som ska koncentreras. Detta gör att de är mindre täta och flyter på ytan. Supernatantvätskan samlas upp och ses under ett mikroskop för identifiering och kvantifiering..
Denna metod används för att visualisera helminthägg. I sin tur har det visat sig vara en mycket känslig metod för diagnos av Giardia lamblia, en flagellerad protozo som sprids över hela världen. Flytningsmetoder rekommenderas inte för mycket tunga parasitägg som bandmaskar och trematoder..
Parasiter är en av de mest utbredda tarminfektionerna världen över, särskilt i fattiga länder med dåliga sanitära åtgärder. Av denna anledning är det mycket användbart att ha känsliga metoder som möjliggör identifiering och kvantifiering av dessa parasiter för diagnos och behandling..
Artikelindex
- 1 Grund och material
- 1.1 Material
- 2 steg
- 2.1 Makroskopisk och mikroskopisk undersökning
- 2.2 Original Faust-teknik
- 2.3 Faustteknik genom centrifugering
- 3 Fördelar
- 4 Nackdelar
- 5 Referenser
Grund och material
Tekniken baseras på förekomsten av de olika specifika vikterna hos ägg, parasiter, cystor, larver och detritus, med zinksulfatlösningar som en flotationsmetod..
Motivet för tekniken är att blanda provet med en zinksulfatlösning som har högre densitet än lättare ägg, larver eller parasiter..
Detta gör att de tyngsta elementen kan fällas ut och de lättare att flyta som dyker upp i supernatanten efter centrifugering av proverna..
Material
- Bered en zinksulfatlösning med en densitet på 1,18 eller 1,2 g / ml om provet tidigare behandlats.
- Förbered ett rack med tidigare märkta provrör.
- Ha en centrifugalmaskin.
- Ha objektglas och täckglas till hands. Alla måste vara märkta
- Se till att det finns en Lugols lösning för att fläcka lakan.
- Ha gasbindning att filtrera.
- Ha trattar och destillerat vatten.
- Leta upp märkta plast- eller kartongbehållare.
- Även applikatorer och sterilt handtag på 5 mm.
- En tändare för att sterilisera handtaget.
Steg
Makroskopisk och mikroskopisk undersökning
För varje avföringsundersökning börjar undersökningen med det som kallas "makroskopisk undersökning" av proverna..
Konsistensen, färgen, närvaron av vad som verkar vara blod, närvaron av slem och närvaron av vuxna parasiter beskrivs..
Sedan fortsätter vi till "mikroskopisk undersökning" av avföringen, detta beror på metoden. Det enklaste är metoden med direkt smet, vilket är den enklaste mikroskopiska observationsmetoden för parasiter..
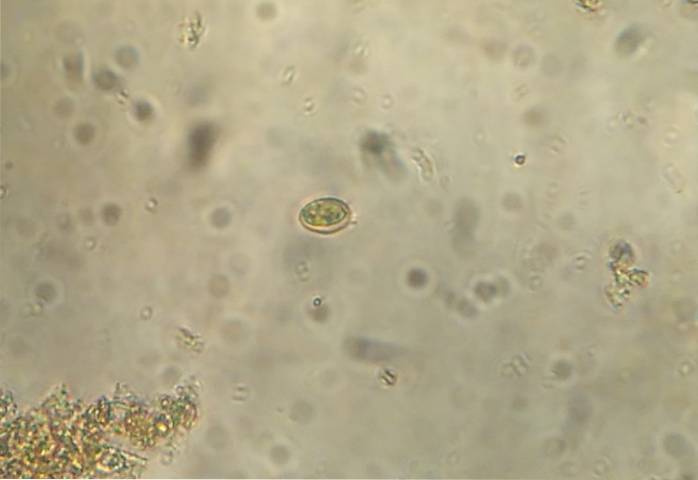
Förfarandet innebär att man placerar en liten mängd av provet direkt på en bild. Placera flera droppar saltlösning som ska ha samma storlek som provet. Blanda saltlösningen med avföringen tills en homogen blandning bildas. Placera ett täckglas och undersök under mikroskopet.
Original Faust-teknik
Det andra förfarandet består av Faust-flotationsmetoden, vars ursprungliga version består av:
1 - Placera ungefär två gram avföring i en lämplig behållare för detta ändamål.
2- Tillsätt 30 ml zinksulfatflotationslösning med vilken en emulsion framställs genom att blanda lösningen med avföringen.
3- Sil med en metallfilter i en andra behållare och överför till ett provrör.
4- Tillsätt fler flytlösningar tills en menisk bildas i röret.
5- Lägg ett täckglas på menisken. Låt det vila i 10 till 15 minuter.
6- Ta bort täckglaset och placera det på en bild som kommer att undersökas under mikroskopet.
Faustteknik genom centrifugering
Ursprungligen använde metoden inte centrifugering, men den ingår nu eftersom bättre resultat uppnås. Tekniken innefattar en serie steg för att uppnå ett korrekt förfarande, dessa är som följer:
1- Avföringen tvättas med vatten, blandas väl och filtreras sedan med gasväv i fyra. Provet placeras i ett provrör.
2- Centrifugera och ta bort supernatanten (prover som hålls över vatten). Steg 1 och 2 upprepas tills supernatanten är "klar".
3- Zinksulfat tillsätts till det filtrerade och centrifugerade provet.
4- Blandar väl.
5- Centrifugera igen i 1 minut vid 2500 rpm (varv per minut).
6- Supernatanten utvinns med en steril ögla på cirka 5 mm; rören ska inte skakas.
7- Provet som utvunnits från supernatanten placeras på ett objektglas och en droppe Lugol kan placeras för att färga, täckglaset placeras och observeras under mikroskopet.
8- Behållarna och provrören är märkta.
Fördel
- Elementen som används för diagnosen kan observeras rena och utan ”detritus”, detta underlättar observationen av arket och minskar tiden som används för diagnosen..
- I supernatanten återvinns både larver, ägg och / eller cystor.
- Det är en mycket låg kostnad metod.
- Förfarandet är mycket enkelt och lätt att genomföra.
- Diagnosen är snabb och korrekt.
- På grund av vikten och den höga förekomsten av parasitos i fattiga länder är dessa billiga och lättanvända metoder idealiska för diagnos och övervakning av dessa patologier..
Nackdelar
Flotationslösningens densitet ger en sammandragning av larverna, det vill säga de krymper och kan deformeras på mycket kort tid. Detta tvingar granskaren att ställa diagnosen omedelbart och de behandlade proverna kan inte förvaras för framtida undersökningar..
Som med alla mikroskopiska identifieringsmetoder krävs en mycket erfaren undersökande personal för att göra korrekta diagnoser..
Den snabba deformationen av elementen som är nödvändiga för diagnosen, även om de är en uppenbar nackdel, kan korrigeras genom att göra omedelbara mikroskopiska observationer.
Referenser
- Ananias, F. L. (2017). Utvärdering av Faust-metodens känslighet och spontan sedimentering för diagnos av giardiasis. Cuban Journal of Tropical Medicine, 68(två).
- Bartlett, M. S., Harper, K., Smith, N., Verbanac, P., & Smith, J. W. (1978). Jämförande utvärdering av en modifierad zinksulfatflotationsteknik. Journal of clinical microbiology, 7(6), 524-528.
- Becker, A. C., Kraemer, A., Epe, C., & Strube, C. (2016). Känslighet och effektivitet för utvalda samskopiska metoder - sedimentering, kombinerad zinksulfatsedimentering-flotation och McMaster-metod. Parasitologiforskning, 115(7), 2581-2587.
- Garcia, L. S., Arrowood, M., Kokoskin, E., Paltridge, G. P., Pillai, D. R., Procop, G. W.,… & Visvesvara, G. (2018). Laboratoriediagnos av parasiter från mag-tarmkanalen. Kliniska mikrobiologiska recensioner, 31(1), e00025-17.
- Summers, W. A. (1942). En modifiering av zinksulfatcentrifugalflotationsmetod för utvinning av helminth-ägg i formaliniserad avföring. Journal of Parasitology, 28(4), 345-346.


Ingen har kommenterat den här artikeln än.