
Kan Grünwald-Giemsa fläcka motiveringen, tekniken och användningen

De Kan Grünwald-Giemsa fläcka o Pappenheim är en differentiell färgningsteknik som blandar Giemsa och May Grünwald-reagens. Det används för differentiering av normala och onormala blodkroppar i perifert blod och benmärgsutstryk samt för färgning av histologiska sektioner och cytologiska prover..
Båda reagensen -Giemsa och May Grünwald- härrör från färgning av Romanowsky-typ, en teknik som baseras på kombinationen av sura och basiska färgämnen..
Giemsa förbättrade tekniken genom att stabilisera blandningen av eosin, metylenblått och deras derivat med glycerol. Istället använder May Grünwald eosin och metylenblått, med metanol som lösningsmedel. Denna strategiska kombination har gett utmärkta resultat.
Även om det i termer av observation av cellmorfologi verkar på samma sätt som Giemsa och Wright-fläckarna, förbättrar denna teknik de tidigare genom att förfina färgningen av parasiterna som orsakar malaria, Chagas sjukdom, leishmaniasis och trichomoniasis..
Dessutom har det visat sig vara en mycket användbar teknik för den cytologiska studien av spermatisk vätska. Det har sticker ut inte bara genom att visa spermatozoernas morfologiska egenskaper utan också genom att möjliggöra differentiering av leukocyter, epitelceller och spermatogenesceller med stor effektivitet..
Artikelindex
- 1 Motivering
- 1.1 Olika färgämnen
- 2 Teknik
- 2.1 Material
- 2.2 Koncentrerad färglösning av Grünwald maj
- 2.3 Koncentrerad Giemsa-fläck
- 2.4 Beredning av buffertlösning vid pH 7,2
- 2.5 Blod- eller benmärgsfärgningsförfarande
- 2.6 Teknik för färgning av utstryk av spermatisk vätska
- 2.7 Viktiga specifikationer
- 3 användningsområden
- 3.1 Vaginal cytologi
- 3.2 Spermaprov
- 4 Referenser
Grund
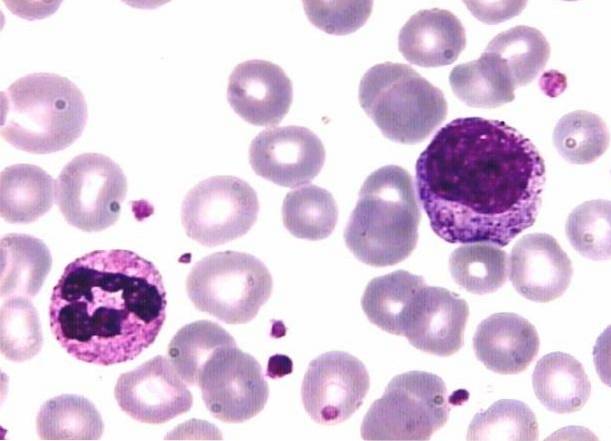
Tekniken följer grunden för Romanowsky-fläckar, där sura färgämnen har selektiv affinitet för basiska cellulära komponenter och sura komponenter lockar basiska fläckar..
Förklaras på ett annat sätt, både cellstrukturer och färgämnen har positiva eller negativa elektriska laddningar; som avgifter avvisar och olika avgifter lockar.
Till exempel är grundläggande färgämnen som metylenblått positivt laddade och lockas av negativt laddade strukturer. Det är därför detta färgämne fläckar kärnor som är rika på DNA och RNA som har negativt laddade fosfatgrupper..
Granulerna av segmenterade basofiler och cytoplasman i mononukleära vita blodkroppar innehållande RNA färgas också..
På samma sätt bär syrafärgämnet en negativ laddning, varför den binder till positivt laddade strukturer såsom erytrocyter och granulat av segmenterade eosinofiler. När det gäller granulerna i de segmenterade neutrofilerna fixerar dessa båda färgämnena.
Olika färgämnen
I denna teknik existerar en kombination av reaktioner mellan ortokromatiska och metakromatiska färgämnen. Ortokromatika (eosin och metylenblått) binder till cellstrukturen som de är relaterade till och ger en stabil färg som inte varierar.
Å andra sidan varierar metakromatika (derivaten av metylenblått azurblå A och azurblå B) sin ursprungliga färg när de väl är fästa vid den specifika strukturen, och det kan till och med finnas en mängd olika nyanser.
Slutligen kräver steget som May Grünwald-lösningen tar närvaro av vatten, eftersom utan detta kommer färgämnet att tränga igenom strukturerna men inte stelna. För att detta ska hända måste färgämnet bli polärt eller jonisera och därmed kunna fälla ut och binda till relaterade strukturer..
Metod
Material
- Mikroskopglas.
- Broar för färgning.
- May-Grünwald-lösningen.
- Giemsa fläck.
- Destillerat vatten.
Kan Grünwald färga koncentrerad lösning
0,25 g eosin-metylenblått (fläck enligt May Grünwald) bör vägas upp och lösas i 100 ml metanol. Sedan blandas preparatet i 1 timme och får vila i 24 timmar. När tiden är ute läcker den.
För att tillämpa tekniken måste May Grünwald-färgämnet spädas enligt följande: för 200 ml utspätt färgämne, mät 30 ml av den koncentrerade lösningen, tillsätt 20 ml buffertlösning och 150 ml destillerat vatten justerat till pH7,2-7,3. Senare blandas den och filtreras.
Giemsa fläckkoncentrat
0,5 g azurblå-eosin-metylenblått (fläck enligt Giemsa) måste vägas, lösas i 50 ml metanol och 50 ml glycerin tillsättas till blandningen.
För att utföra tekniken späds den 1:10 med buffertlösning och får stå i 10 minuter. Kan filtreras vid behov.
Beredning av buffertlösningen vid pH 7,2
De bör vägas:
- 40 mg kaliumdivätefosfat (KH2PO4).
- 151 mg di-natriumvätefosfat 12-hydrat (Na2HPO4).
Båda föreningarna löses i 100 ml vatten.
Blod- eller benmärgsfärgningsförfarande
Det finns två lägen: en klassiker och en snabb.
Klassiskt läge
- Täck utstryk i 2 till 3 minuter med den utspädda May-Grünwald-lösningen..
- Tvätta med buffrat destillerat vatten för att ta bort den tidigare lösningen.
- Täck med samma buffrade tvättlösning och låt stå i 1 minut. Tanken är att föregående färgämne är fäst vid strukturerna och att cellerna samtidigt hydratiseras.
- Tillsätt 12 droppar utspädd Giemsa-tinktur till det buffrade vattnet och blås för att blanda och homogenisera. Låt stå i 15-20 minuter.
- Tvätta utstryk med buffrat destillerat vatten och lufttorka.
- Fokusera och observera de färgade blodkropparna under ett ljusmikroskop med 40X-målet. Om det behövs kan 100X användas.
Snabbläge
- Täck utstryk med utspädd May Grünwald-fläck i 1 minut..
- Tvätta med buffrat destillerat vatten.
- Täck med buffrat vatten och låt stå i 1 minut.
- Placera den utspädda Giemsa-fläcken och låt stå i 5 minuter.
- Tvätta med buffrat destillerat vatten och låt det lufttorka.
De tekniker som beskrivs här är en riktlinje, men det bör beaktas att procedurerna och färgningstiderna varierar beroende på det kommersiella företaget som distribuerar reagensen. Det är tillrådligt att följa de steg som strikt anges av varje kommersiellt hus.
Teknik för färgning av utstryk av spermatvätska
1- Täck utstrykningen med ett tunt lager av May Grünwald-lösningen i 4 minuter.
2- Ta bort färgämnet och tvätta med destillerat vatten.
3- Lägg ett lager utspädd Giemsa (1:10) i destillerat vatten i 15 minuter.
4- Ta bort färgämnet och tvätta med destillerat vatten.
5- Låt torka och observera i mikroskopet.
Viktiga specifikationer
Tekniken kräver att reagensen och tvättlösningarna har ett pH justerat till 7,2-7,3, så att färgämnena för cellstrukturerna inte förvrängs och den förväntade slutfärgen inte varierar..
Applikationer
Denna teknik används av kliniska laboratorier för att fläckar perifert blod och benmärgsutstryk, vävnadsavsnitt och cytologier..
Inom det hematologiska området är denna teknik av avgörande betydelse vid studier av cellernas abnormiteter när det gäller form, storlek och antal. Det är ett mycket värdefullt verktyg för diagnos av vissa sjukdomar, såsom leukemier och anemier.
Dessutom är det av enastående nytta när man letar efter parasiter i hematologiska områden (Plasmodium sp Y Trypanosome cruzi) eller histologisk (Leishmanias sp).
Vaginal cytologi
När det gäller vaginal cytologi är denna teknik särskilt fördelaktig för observation av Trichomonas vaginalis. Detta är ett viktigt resultat, eftersom dess närvaro simulerar bilder av karcinom. in situ som sedan försvinner när parasiten avlägsnas.
Spermaprov
Det har varit ett idealiskt verktyg för studier av spermieprover, eftersom det ger värdefull information om spermiernas kvalitet.
Uppgifterna har huvudsakligen att göra med antal och morfologi, såväl som de samtidig celler som kan finnas och som är av vital betydelse, såsom könsceller, leukocyter och epitelceller..
Med denna analys är det möjligt att beskriva abnormiteter observerade i spermierna i huvudet, nacken, mittstycket och huvuddelen..
Dessutom kan de också hjälpa till att visa fall av hemospermi (närvaro av röda blodkroppar i sperma) och leukospermi eller piospermi (ökat antal leukocyter i sperma).
Referenser
- Costamagna S, Prado M. Validering av det nya testet, May Grünwald-Giemsa och Gram fläckar och odlingsmedier för diagnos av Trichomonas vaginalis. Parasitol. 2001; 25 (1-2): 60-64. Finns i: scielo.
- Merck KGaA-laboratorium. Maj Grünwald eosin metylenblått för mikroskopi.
- "May-Grünwald-Giemsa fläck." Wikipedia, den fria encyklopedin. 15 nov 2018, 14:37 UTC. 8 jan 2019, 04:29: en.wikipedia.org
- Panreac-laboratorium för glaskemikalier. Reagens för histologisk teknik, hematologi och mikrobiologi. Finns på: glasschemicals.com
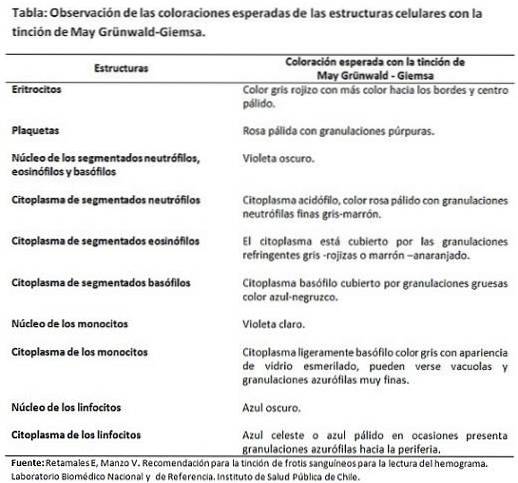
- Retamales E, Manzo V. Rekommendation för färgning av blodutstryk för läsning av hemogrammet. Nationellt och referensbiomedicinskt laboratorium. Institutet för folkhälsa i Chile.
- Sarabia L. Spermiogram enligt WHO-kriterier. Utvecklingsanatomi och biologiprogram. Medicinsk skola. University of Chile. Finns på: pp.centramerica.com



Ingen har kommenterat den här artikeln än.