
Natriumtiosulfat (Na2S2O3) formel, egenskaper och användningsområden
De natriumtiosulfat eller natriumhyposulfit (NatvåStvåELLER3) Det är ett viktigt oorganiskt salt med olika medicinska användningsområden. Det finns också som dess pentahydrerade salt (NatvåStvåELLER3.5HtvåELLER).
Det är en jonförening bildad av två natriumkatjoner (Na+och den negativt laddade tiosulfatanjonen (StvåELLER3-), där den centrala svavelatomen är kopplad till tre syreatomer och en annan svavelatom (därav prefixet farbror), genom enkel- och dubbelbindningar med resonanskaraktär. Det fasta ämnet finns i en monoklinisk kristallstruktur.
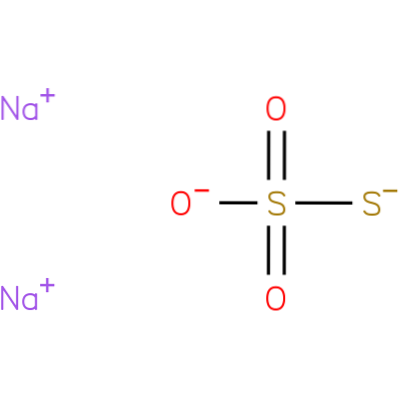
Natriumtiosulfat kan framställas genom upphettning av svavel med en vattenlösning av natriumsulfit eller en vattenlösning av natriumhydroxid..
6NaOH + 4S → NatvåStvåELLER3 + 2NatvåS + 3HtvåELLER
Det är ett läkemedel som finns på Världshälsoorganisationens lista över essentiella läkemedel, de mest effektiva och säkra läkemedlen som behövs i ett hälsosystem (Sodium Thiosulfate Formula, S.F.).
Artikelindex
- 1 Fysikaliska och kemiska egenskaper
- 2 Reaktivitet och faror
- 3 användningsområden
- 3.1 Medicin
- 3.2 Jodmetri
- 3.3 Avklorering av vatten
- 3.4 Guldbrytning
- 4 Referenser
Fysiska och kemiska egenskaper
Natriumtiosulfat har en molekylvikt på 158,11 g / mol för sin vattenfria form och 248,18 g / mol för pentahydratformen. Dessutom har den en densitet på 1667 g / ml (National Center for Biotechnology Information., 2017).
Natriumtiosulfat är färglösa monokliniska kristaller utan en karakteristisk arom. Nämnda fasta ämne är lysande, vilket innebär att det i sig kan reduceras till damm genom förlust av kristallvatten när det utsätts för luft. Dess utseende visas i figur 2.

Föreningen har en smältpunkt på 48 ° C för pentahydratformen och från 100 ° C börjar den sönderdelas. Då entvåStvåELLER3 Det är mycket lösligt i vatten och kan lösa upp 70 gram per 100 ml lösningsmedel. Föreningen är praktiskt taget olöslig i etanol (Royal Society of Chemistry, 2015).
Natriumtiosulfat är ett neutralt salt som lätt dissocieras i vatten för att ge natrium- och tiosulfatjoner. NatvåStvåELLER3 Det är ett stabilt fast ämne under normala förhållanden, men sönderdelas vid upphettning för att ge natriumsulfat och natriumpolysulfid:
4NatvåStvåELLER3 → 3NatvåSW4 + NatvåS5
Det bryts också ner när det behandlas med utspädda syror för att ge svavel och svaveldioxid (kallas klockreaktionen):
NatvåStvåELLER3 + 2HCl → 2NaCl + S + SOtvå + HtvåELLER
Reagerar stökiometriskt (i ekvimolära mängder) med vattenhaltiga jodlösningar, vilket gör det allmänt använt i laboratorier för jodbaserade titreringar.
Reaktivitet och faror

Natriumtiosulfat är inte ett giftigt material och används för medicinska ändamål. Men när det sönderdelas producerar det giftiga svaveloxidångor som kan orsaka irritation i ögon, hud och slemhinnor..
Föreningen kan irritera ögonen, huden och luftvägarna. Ämnet är giftigt för lungor och slemhinnor. Upprepad eller långvarig exponering för ämnet kan orsaka skador på dessa organ..
Om förening kommer i kontakt med ögonen bör kontaktlinser kontrolleras och tas bort. Ögonen ska spolas omedelbart med mycket vatten i minst 15 minuter med kallt vatten.
Vid hudkontakt ska det drabbade området sköljas omedelbart med mycket vatten i minst 15 minuter, medan kontaminerade kläder och skor avlägsnas. Täck irriterad hud med ett mjukgörande medel. Tvätta kläder och skor före återanvändning. Om kontakten är svår, tvätta med desinfektionsmedel och täck den förorenade huden med en antibakteriell kräm.
Vid inandning ska offret flyttas till en sval plats. Om du inte andas ges artificiell andning. Om det är svårt att andas, ge syre.
Om föreningen intas ska kräkningar inte induceras såvida det inte föreskrivs av medicinsk personal. Lossa trånga kläder som en skjortkrage, bälte eller slips.
I alla fall bör omedelbar läkarvård fås. (Säkerhetsdatablad Natriumtiosulfat vattenfritt, 2013).
Applikationer
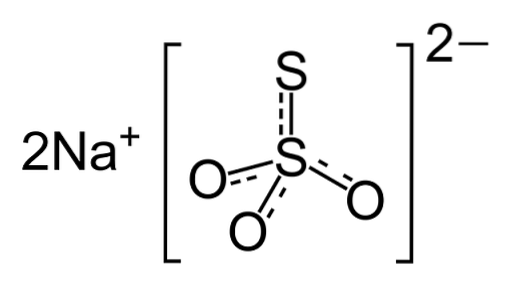
Medicin
Natriumtiosulfat kan användas för att minska några av biverkningarna av cisplatin (ett cancerläkemedel). Det används vid hantering av extravasationer under kemoterapi. Natriumtiosulfat förhindrar alkylering och vävnadsförstöring genom att tillhandahålla ett substrat för alkyleringsmedel som har invaderat subkutan vävnad.
Det används också med ett annat läkemedel vid akutbehandling av cyanidförgiftning (U.S. National Library of Medicine, S.F.).
I denna behandling injiceras natriumnitrit intravenöst för att producera hemoglobin som kombineras med cyanidjonen och temporärt omvandlas till cyanmetoglobinformen. Därefter injiceras natriumtiosulfatet.
Tiosulfat fungerar som ett substrat för enzymet rhodanas, som katalyserar omvandlingen av cyanid till det mycket mindre toxiska tiocyanatet, som utsöndras i urinen (HSDB: SODIUM THIOSULFATE, 2003).
Natriumtiosulfat används också som behandling för kalcifylax hos personer i hemodialys med njursjukdom i slutstadiet. Det finns tydligen ett inte helt förstått fenomen, varigenom detta orsakar svår metabolisk acidos hos vissa patienter..
Jodometri
Natriumtiosulfat reagerar stökiometriskt med jod för att ge jodid enligt reaktionen:
2NatvåStvåELLER3 + I2 → S4ELLER62− + 2I-
Denna egenskap gör att föreningen används som titreringsmedel vid bestämning av jod..
Denna speciella användning kan fastställas för att mäta syrehalten i vatten genom en lång serie reaktioner i Winkler-testet för löst syre..
Det används också i den volymetriska uppskattningen av koncentrationerna av vissa föreningar i lösning (väteperoxid, till exempel) och vid uppskattningen av klorhalten i kommersiellt pulveriserat blekmedel och vatten..
Vattenavklorering
Natriumtiosulfat används för att klorinera vatten, inklusive sänkning av klornivåer för användning i akvarier och simbassänger och spa och inom vattenreningsanläggningar för att behandla etablerat bakvatten före utsläpp.
Reduktionsreaktionen är analog med jodreduktionsreaktionen, tiosulfat minskar hypoklorit (aktiv beståndsdel i blekmedel) och oxiderar därigenom till sulfat. Den fullständiga reaktionen är:
4NaClO + NatvåStvåELLER3 + 2NaOH → 4NaCl + 2NatvåSW4 + HtvåELLER
Guld grävning
Natriumtiosulfat är en komponent som används som ett alternativt lakmedel till cyanid för guldutvinning. Det bildar emellertid ett starkt lösligt komplex med guld (I) jonerna, [Au (StvåELLER3)två]3-.
Fördelen med detta tillvägagångssätt är att tiosulfat i huvudsak är giftfritt och att mineraltyper som är eldfasta mot guldcyanidering kan läcka ut av tiosulfat (M.G Aylmore, 2001).
Referenser
- EMBL-EBI. (2016, 1 juni). natriumtiosulfat. Återställd från ebi.ac.uk: ebi.ac.uk.
- HSDB: NATRIUMTIOSULFAT. (2003, 3 maj). Återställd från toxnet: toxnet.nlm.nih.gov.
- G Aylmore, D. M. (2001). Tiosulfatlakning av guld-A-granskning. Minerals Engineering Volym 14, utgåva 2, 135-174. sciencedirect.com.
- Säkerhetsdatablad Natriumtiosulfat vattenfritt. (2013, 21 maj). Återställd från sciencelab.com.
- Nationellt centrum för bioteknikinformation ... (2017, 18 mars). PubChem Compound Database; CID = 24477. Återställd från pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Natriumtiosulfat. Återställd från chemspider.com.
- Natriumtiosulfatformel. (S.F.). Återställd från softschools: softschools.com.
- S. National Library of Medicine. (S.F.). Natriumtiosulfat (i en ven). Återställd från ncbi.nlm.nih.gov.



Ingen har kommenterat den här artikeln än.