
Transamineringsmekanism, funktion och exempel
De transaminering är en typ av kemisk reaktion som fungerar vid "omfördelning" av aminogrupper mellan aminosyror, eftersom det involverar reversibla amineringsprocesser (tillsats av en aminogrupp) och deaminering (eliminering av en aminogrupp), som katalyseras av specifika kända enzymer som transaminaser eller aminotransferaser.
Den allmänna transamineringsreaktionen involverar utbytet mellan en aminosyra och vilken a-ketosyra som helst, där utbytet av en aminogrupp ger keto-syraversionen av den första substrataminosyran och aminosyraversionen av det första substratet a-ketosyra..

Aminogruppen som vanligtvis byts ut är "alfa" amino, det vill säga den som deltar i bildandet av peptidbindningar och som definierar aminosyrans struktur, även om reaktioner som involverar andra aminogrupper som finns i olika positioner också kan förekomma..
Med undantag av lysin, treonin, prolin och hydroxiprolin deltar alla aminosyror i transamineringsreaktioner, även om transaminaser har beskrivits för histidin, serin, metionin och fenylalanin, men deras metaboliska vägar involverar inte denna typ av reaktioner..
Transamineringsreaktionerna mellan aminosyror och α-ketosyror upptäcktes 1937 av Braunstein och Kritzmann, och sedan dess har de varit föremål för intensiva studier, eftersom de förekommer i många vävnader av olika organismer och med olika syften..
Hos människor distribueras till exempel transaminaser i stor utsträckning i kroppsvävnader och är särskilt aktiva i hjärtmuskelvävnad, lever, skelettmuskulatur och njurar..
Artikelindex
- 1 Reaktionsmekanism
- 2 Transamineringens funktion
- 3 Exempel
- 4 Referenser
Reaktionsmekanism
Transamineringsreaktioner involverar mer eller mindre samma mekanism. Som diskuterats ovan inträffar dessa reaktioner som ett reversibelt utbyte av en aminogrupp mellan en aminosyra och en a-ketosyra (deaminerad), vilket producerar a-ketosyran i donatoraminosyran och aminosyran i a-ketosyran receptorn..
Dessa reaktioner beror på en förening som kallas pyridoxalfosfat, ett derivat av vitamin B6 som deltar som en transportör av aminogrupper och som binder till transaminasenzymer genom bildandet av en Schiff-bas mellan aldehydgruppen i denna molekyl och ε-amino av en lysinrest i enzymets aktiva plats.
Bindningen mellan pyridoxalfosfat och lysinresten i det aktiva stället är inte kovalent, utan sker genom den elektrostatiska interaktionen mellan den positiva laddningen av kväve på lysin och den negativa laddningen på fosfatgruppen i pyridoxal.
Under reaktionen förskjuter aminosyran som fungerar som ett substrat ε-aminogruppen i lysinresten i det aktiva stället som deltar i Schiff-basen med pyridoxal.
Under tiden avlägsnas ett par elektroner från aminosyrans alfakolv och överförs till pyridinringen som utgör pyridoxalfosfat (positivt laddad) och sedan "levereras" till α-ketosyran som fungerar som ett andra substrat..
På detta sätt deltar pyridoxalfosfat inte bara i överföringen eller transporten av aminogrupper mellan aminosyror och α-keto-syror som är substrat för transaminaser, utan fungerar också som en "sänkning" av elektroner, vilket underlättar dissociationen av alfa-aminosyraväte.
Sammanfattningsvis överför det första substratet, en aminosyra, sin aminogrupp till pyridoxalfosfat, varifrån det därefter överförs till det andra substratet, en a-ketosyra, som under tiden bildar en mellanförening känd som pyridoxaminfosfat..
Transamineringens funktion
Transaminasenzymer finns vanligtvis i cytosolen och mitokondrierna och fungerar i integrationen av olika metaboliska vägar.
Glutamatdehydrogenas i sin omvända reaktion kan till exempel omvandla glutamat till ammonium, NADH (eller NADPH) och α-ketoglutarat, som kan komma in i trikarboxylsyracykeln och fungera i energiproduktion.
Detta enzym, som finns i mitokondriell matris, representerar en grenpunkt som associerar aminosyror med energimetabolism, så att när en cell saknar tillräckligt med energi i form av kolhydrater eller fetter för att fungera, kan den alternativt använda vissa aminosyror för samma syfte.
Bildandet av enzymet (glutamatdehydrogenas) under hjärnans utveckling är viktigt för kontrollen av ammoniumavgiftning, eftersom det har visat sig att vissa fall av mental retardation har att göra med en låg aktivitet av detta, vilket leder till ammoniumuppbyggnad, vilket är skadligt för hjärnans hälsa.
I vissa leverceller kan transamineringsreaktioner också användas för syntes av glukos genom glukoneogenes.
Glutamin omvandlas till glutamat och ammonium av enzymet glutaminas. Glutamat omvandlas sedan till α-ketoglutarat, som går in i Krebs-cykeln och sedan glukoneogenes. Detta sista steg inträffar tack vare att malat, en av ruttens produkter, transporteras ut ur mitokondrier med hjälp av en skyttel..
Denna skyttel lämnar α-ketoglutarat på grund av det malic enzymet, som omvandlar det till pyruvat. Två pyruvatmolekyler kan sedan omvandlas till en glukosmolekyl genom glukoneogenes..
Exempel
De vanligaste transamineringsreaktionerna är relaterade till aminosyrorna alanin, glutaminsyra och asparaginsyra..
Vissa aminotransferasenzymer kan, förutom pyridoxalfosfat, använda pyruvat som ett "koenzym", såsom glutamat-pyruvat-transaminas, vilket katalyserar följande reaktion:
glutamat + pyruvat ↔ alanin + α-ketoglutarat
Muskelceller är beroende av denna reaktion för att producera alanin från pyruvat och för energi genom Krebs-cykeln via α-ketoglutarat. I dessa celler beror användningen av alanin som energikälla på eliminering av aminogrupper såsom ammoniumjoner i levern genom ureacykeln..
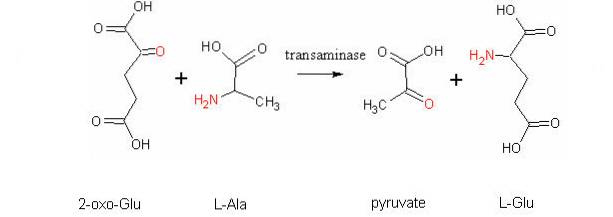
En annan mycket viktig transamineringsreaktion hos olika arter är den som katalyseras av enzymet aspartataminotransferas:
L-aspartat + α-ketoglutarat ↔ Oxaloacetat + L-glutamat
Sist men inte minst, transamineringsreaktionen av γ-aminosmörsyra (GABA), en icke-proteinaminosyra som är väsentlig för det centrala nervsystemet som fungerar som en hämmande neurotransmittor. Reaktionen katalyseras av ett y-aminosmörsyra-transaminas och är ungefär som följer:
α-ketoglutarat + 4-aminobutansyra ↔ Glutamat + bärnstenssyra semialdehyd
Bärnstenshalvsemialdehyd omvandlas till bärnstenssyra genom en oxidationsreaktion och den senare kan komma in i Krebs-cykeln för energiproduktion.
Referenser
- Bhagavan, N. V., & Ha, C. E. (2002). Protein- och aminosyrametabolism. Medicinsk biokemi (4: e upplagan), Academic Press: San Diego, CA, USA, 331.
- Cammarata, P. S. och Cohen, P. P. (1950). Omfattningen av transamineringsreaktionen i djurvävnader. Journal of Biological Chemistry, 187, 439-452.
- Ha, C. E., & Bhagavan, N. V. (2011). Essentials of medical biochemistry: med kliniska fall. Academic Press.
- Litwack, G. (2017). Mänsklig biokemi. Academic Press.
- Rowsell, E. V. (1956). Transamineringar med pyruvat och andra α-ketosyror. Biochemical Journal, 64 (2), 246.
- Snell, E. E. och Jenkins, W. T. (1959). Transamineringsreaktionens mekanism. Journal of cellular and comparative physiology, 54 (S1), 161-177.



Ingen har kommenterat den här artikeln än.