
Zinkoxid (ZnO) struktur, egenskaper, användningsområden, risker

De zinkoxid Det är en oorganisk förening vars kemiska formel är ZnO. Den består enbart av Zn-jonertvå+ migtvå- i ett förhållande 1: 1; emellertid kan dess kristallina gitter uppvisa en vakans av Otvå-, vilket ger upphov till strukturella defekter som kan ändra färgerna på dina syntetiska kristaller.
Det förvärvas kommersiellt som ett pulverformigt vitt fast ämne (lägre bild), som produceras direkt från oxidationen av metalliskt zink genom den franska processen; eller utsätta zinkmalmer för karbotermisk reduktion, på ett sådant sätt att deras ångor oxideras och slutar stelna.

Andra metoder för framställning av ZnO består av att fälla ut dess hydroxid, Zn (OH)två, från vattenhaltiga lösningar av zinksalter. På samma sätt kan morfologiskt varierade tunna filmer eller nanopartiklar av ZnO syntetiseras med mer sofistikerade tekniker såsom kemisk avsättning av dess ångor..
Denna metalloxid finns i naturen som mineral zinkit, vars kristaller vanligtvis är gula eller orange på grund av metallföroreningar. ZnO-kristaller kännetecknas av att de är piezoelektriska, termokroma, självlysande, polära och också har ett mycket brett energiband i sina halvledaregenskaper.
Strukturellt är den isomorf till zinksulfid, ZnS, som antar sexkantiga och kubiska kristaller som liknar de hos wurzit respektive blende. I dessa finns det en viss kovalent karaktär i interaktionerna mellan Zntvå+ migtvå-, vilket orsakar en heterogen fördelning av laddningar i ZnO-kristallen.
Studier av egenskaperna och användningarna av ZnO sträcker sig till områdena fysik, elektronik och biomedicin. Dess enklaste och mest vanliga användningsområden går obemärkt förbi i ansiktskrämer och hygienprodukter samt i solskyddsmedel.
Artikelindex
- 1 Struktur
- 1.1 Polymorfer
- 1.2 Interaktioner
- 1.3 Nanopartiklar morfologi
- 2 fastigheter
- 2.1 Fysiskt utseende
- 2.2 Molmassa
- 2.3 Smältpunkt
- 2.4 Densitet
- 2.5 Löslighet i vatten
- 2.6 Amfoterism
- 2.7 Värmekapacitet
- 2.8 Direkt energiklyfta
- 3 användningsområden
- 3.1 Läkemedel
- 3.2 Antibakteriell
- 3.3 Pigment och beläggningar
- 3.4 Biobilder
- 3.5 Tillsats
- 3.6 Vätesulfidavskiljare
- 4 risker
- 5 Referenser
Strukturera
Polymorfer
ZnO kristalliserar under normala förhållanden av tryck och temperatur i en sexkantig wurzitstruktur. I denna struktur är Zn-jonernatvå+ migtvå- är ordnade i alternerande lager, på ett sådant sätt att var och en hamnar omgiven av en tetraeder, med ZnO4 eller OZn4, respektive.
Med användning av en "mall" eller ett kubiskt stöd kan ZnO fås att kristallisera till en kubisk struktur av zinkblandning; som, liksom wurzit, motsvarar isomorfa strukturer (identiska i rymden men med olika joner) av zinksulfid, ZnS.
Förutom dessa två strukturer (wurzit och blende) kristalliserar ZnO under högt tryck (cirka 10 GPa) i bergsaltstrukturen, samma som för NaCl.
Interaktioner
Interaktioner mellan Zntvå+ migtvå- uppvisar en viss karaktär av kovalens, så det finns delvis en Zn-O kovalent bindning (båda atomer med sp-hybridisering3), och på grund av förvrängningen av tetraedrarna, manifesterar de ett dipolmoment som ökar de joniska attraktionerna i ZnO-kristallerna.
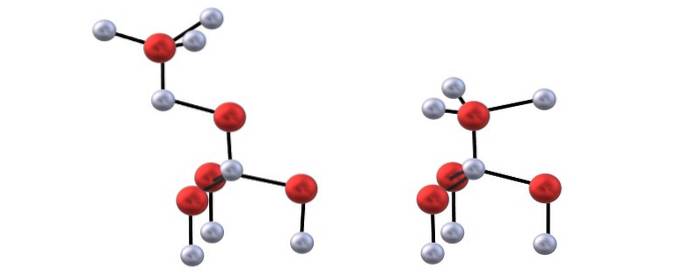
Du har den övre bilden för att visualisera tetraederna som nämns för ZnO-strukturerna.
Skillnaden mellan blenda- och wurzitstrukturerna ligger också i det faktum att jonerna inte är förmörkade sett ovanifrån. Till exempel, i wurzit, uppskattas det att de vita sfärerna (Zntvå+) ligger precis ovanför de röda sfärerna (Otvå-). Å andra sidan händer detta inte i den kubiska strukturen för blende eftersom det finns tre lager: A, B och C istället för bara två.
Nanopartiklar morfologi
Även om ZnO-kristaller tenderar att ha sexkantiga wurzitstrukturer, är morfologin för deras nanopartiklar en annan historia. Beroende på parametrar och syntesmetoder kan dessa ha så olika former som stavar, tallrikar, löv, sfärer, blommor, bälten, nålar, bland andra..
Egenskaper
Fysiskt utseende
Vit, luktfri, pulverformig fast substans med en bitter smak. I naturen kan den hittas kristalliserad med metallföroreningar, såsom zinkitmineral. Om sådana kristaller är vita, presenterar de termokromism, vilket innebär att de vid uppvärmning byter färg: från vit till gul..
Likaså kan dess syntetiska kristaller uppvisa rödaktiga eller grönaktiga färger beroende på deras stökiometriska syrekomposition; det vill säga luckorna eller vakanserna orsakade av bristen på anjoner Otvå- påverkar direkt hur ljus interagerar med joniska nätverk.
Molmassa
81,406 g / mol
Smältpunkt
1974 ° C. Vid denna temperatur genomgår den termisk nedbrytning och frigör zinkångor och molekylärt eller gasformigt syre..
Densitet
5,1 g / cm3
Vattenlöslighet
ZnO är praktiskt taget olösligt i vatten och ger knappast lösningar med en koncentration på 0,0004% vid 18 ºC.
Amfoterism
ZnO kan reagera med både syror och baser. När den reagerar med en syra i vattenlösning ökar dess löslighet genom att bilda ett lösligt salt där Zntvå+ slutar komplexa med vattenmolekyler: [Zn (OHtvå)6]två+. Det reagerar till exempel med svavelsyra för att producera zinksulfat:
ZnO + HtvåSW4 → ZnSO4 + HtvåELLER
På liknande sätt reagerar det med fettsyror för att bilda sina respektive salter, såsom zinkstearat och palmitat..
Och när det reagerar med en bas, i närvaro av vatten, bildas zinksalterna:
ZnO + 2NaOH + HtvåO → Natvå[Zn (OH)4]
Värmekapacitet
40,3 J / K mol
Direkt energiklyfta
3.3 eV. Detta värde gör det till en bredbands halvledare som kan fungera under intensiva elektriska fält. Det har också egenskaper som att vara en halvledare av typen n, som inte har kunnat förklara skälen till varför det finns ett extra bidrag av elektroner i dess struktur.
Denna oxid kännetecknas av dess optiska, akustiska och elektroniska egenskaper, tack vare vilken den anses vara en kandidat för potentiella applikationer relaterade till utvecklingen av optoelektroniska enheter (sensorer, laserdioder, solceller). Anledningen till sådana egenskaper ligger utanför fysikens rike.
Applikationer
Medicinsk
Zinkoxid har använts som tillsats i många vita krämer för behandling av irritationer, aknes, dermatit, nötning och sprickor i huden. I detta område är dess användning populärt för att lindra irritationer orsakade av blöjor på babyns hud..
Det är också en del av solskyddsmedel, för tillsammans med nanopartiklarna av titandioxid, TiOtvå, Det hjälper till att blockera solens ultravioletta strålning. På samma sätt fungerar det som ett förtjockningsmedel, varför det finns i vissa ljusmakeup, lotioner, emalj, talk och tvål..
Å andra sidan är ZnO en källa till zink som används i kosttillskott och vitaminprodukter, liksom i spannmål..
Antibakteriell
Enligt morfologin hos dess nanopartiklar kan ZnO aktiveras under ultraviolett strålning för att generera väteperoxider eller reaktiva arter som försvagar mikroorganismens cellmembran.
När detta händer får de återstående ZnO-nanopartiklarna att fälla cytoplasman och börja interagera med kompendiet av biomolekyler som utgör cellen, vilket resulterar i apoptos..
Det är därför som inte alla nanopartiklar kan användas i solskyddsmedelkompositioner, utan bara de som saknar antibakteriell aktivitet..
Produkter med denna typ av ZnO är designade, belagda med lösliga polymera material, för att behandla infektioner, sår, sår, bakterier och till och med diabetes..
Pigment och beläggningar
Pigmentet som kallas vit zink är ZnO, som tillsätts till olika färger och beläggningar för att skydda metallytor där de appliceras mot korrosion. Till exempel används beläggningar med tillsatt ZnO för att skydda galvaniserat järn..
Å andra sidan har dessa beläggningar också använts på fönsterglas för att förhindra att värme tränger in (om det är ute) eller tränger in (om det är inne). På samma sätt skyddar det vissa polymera och textila material från försämring på grund av solstrålning och värme..
Biobilder
Luminiscensen hos ZnO-nanopartiklar har studerats för användning vid bioavbildning, och därmed studerat cellernas interna strukturer genom de blå, gröna eller orange lamporna som strålar ut..
Tillsats
ZnO finner också användning som tillsats i gummi, cement, tandkrämsmaterial, glas och keramik på grund av dess lägre smältpunkt och därför fungerar som ett flussmedel..
Vätesulfideliminator
ZnO tar bort obehagliga H-gasertvåJa, hjälper till att avsvavla vissa ångor:
ZnO + HtvåS → ZnS + HtvåELLER
Risker
Zinkoxid som sådan är en giftfri och ofarlig förening, så den försiktiga hanteringen av dess fasta ämne utgör ingen risk..
Problemet ligger dock i dess rök, för även om den vid höga temperaturer sönderfaller, slutar zinkångorna att förorena lungorna och orsaka en slags ”metallfeber”. Denna sjukdom kännetecknas av symtom på hosta, feber, en känsla av täthet i bröstet och en konstant metallsmak i munnen..
Det är inte heller cancerframkallande och krämer som innehåller det har inte visats öka zinkabsorptionen i huden, så ZnO-baserade solskyddsmedel anses säkra; såvida det inte finns allergiska reaktioner, i vilket fall användningen bör avbrytas.
När det gäller vissa nanopartiklar som är utformade för att bekämpa bakterier kan dessa ha negativa effekter om de inte transporteras korrekt till deras verkningsplats..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Zinkoxid. Återställd från: en.wikipedia.org
- Hadis Morkoç och Ümit Özgur. (2009). Zinkoxid: grundläggande, material och utrustningsteknik. [PDF]. Återställd från: application.wiley-vch.de
- Parihar, M. Raja och R. Paulose. (2018). En kort översikt över strukturella, elektriska och elektrokemiska egenskaper hos zinkoxid-nanopartiklar. [PDF]. Återställd från: ipme.ru
- A. Rodnyi och I. V. Khodyuk. (2011). Optiska egenskaper och luminiscensegenskaper hos zinkoxid. Återställd från: arxiv.org
- Siddiqi, K. S., Ur Rahman, A., Tajuddin, & Husen, A. (2018). Egenskaper hos zinkoxidnanopartiklar och deras aktivitet mot mikrober. Nanoskala forskningsbrev, 13 (1), 141. doi: 10.1186 / s11671-018-2532-3
- ChemicalSafetyFacts. (2019). Zinkoxid. Återställd från: chemicalafetyfacts.org
- Jinhuan Jiang, Jiang Pi och Jiye Cai. (2018). Främjandet av zinkoxidnanopartiklar för biomedicinska applikationer. Bioinorganic Chemistry and Applications, vol. 2018, artikel-ID 1062562, 18 sidor. doi.org/10.1155/2018/1062562



Ingen har kommenterat den här artikeln än.