
Fosforoxid (v) struktur, egenskaper, erhållande, användningar, risker

De fosforoxid (v) Det är ett oorganiskt fast ämne bildat av fosfor (P) och syre (O). Dess empiriska formel är PtvåELLER5, medan dess korrekta molekylformel är P4ELLER10. Det är ett mycket hygroskopiskt vitt fast ämne, det vill säga det kan absorbera vatten från luften mycket enkelt och reagera omedelbart med det. Reaktionen kan vara farlig eftersom den orsakar en snabb temperaturökning.
Dess höga tendens att absorbera vatten har fått det att användas som torkmedel i kemiska laboratorier, liksom som en dehydrator av vissa föreningar, det vill säga att eliminera vatten från dess molekyler..

Fosforoxid (v) används också för att påskynda bindningsreaktionerna hos olika kolväte-molekyler, en reaktion som kallas kondensation. Dessutom gör det att omvandla vissa organiska syror till estrar.
Den har exempelvis använts för att förfina bensin, för att bereda fosforsyra H3PO4, att erhålla föreningar som tjänar till att fördröja eld, att göra glas för vakuumapplikationer, bland många andra användningsområden.
Fosforoxid (v) bör förvaras i tätt tillslutna behållare för att förhindra att den kommer i kontakt med fukt i luften. Det är frätande och kan skada ögon, hud och slemhinnor..
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Sublimeringstemperatur
- 3.5 Densitet
- 3.6 Löslighet
- 3.7 Kemiska egenskaper
- 3.8 Övriga egenskaper
- 4 Skaffa
- 4.1 Närvaro i naturen
- 5 användningsområden
- 5.1 Som uttorknings- och torkmedel
- 5.2 I organisk kemi-reaktioner
- 5.3 Vid bränsleraffinering
- 5.4 I olika applikationer
- 6 risker
- 7 Referenser
Strukturera
Fosforoxid (v) består av fosfor (P) och syre (O), där fosfor har en valens på +5 och syre -2. Fosforoxidmolekylen (v) har fyra fosfor- och tio syreatomer och det är därför den korrekta molekylformeln är P4ELLER10.
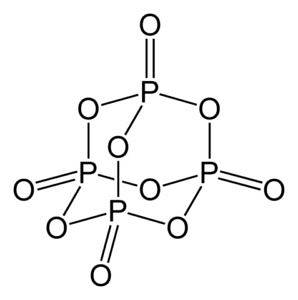
Den finns i tre kristallina former, som amorft pulver och i glashaltig form (som glas). I den sexkantiga kristallina formen finns var och en av de fosforatomerna vid topparna på en tetraeder..
Nomenklatur
- Fosforoxid (v)
- Fosforpentoxid
- Difosforpentoxid
- Fosforpentoxid
- Fosforsyraanhydrid
- Tetrafosfor dekaoxid
Egenskaper
Fysiskt tillstånd
Kristallint vitt fast ämne. Den vanligaste formen är sexkantiga kristaller.
Molekylvikt
283,89 g / mol
Smältpunkt
562 ºC
Sublimeringstemperatur
360 ºC vid 1 atmosfärstryck. Det betyder att den vid denna temperatur går från fast till gas utan att gå igenom flytande tillstånd.
Densitet
2,30 g / cm3
Löslighet
Mycket löslig i vatten. Löslig i svavelsyra. Olöslig i aceton och ammoniak.
Kemiska egenskaper
Fosforoxid (v) absorberar och reagerar extremt snabbt med vatten i luften och bildar fosforsyra H3PO4. Denna reaktion är exoterm, vilket innebär att värme produceras under reaktionen..
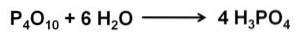
Reaktionen av P4ELLER10 med vatten leder till bildandet av en blandning av fosforsyror vars sammansättning beror på mängden vatten och förhållandena.
Reaktionen med alkoholer leder till bildandet av estrar av fosforsyra eller av polymersyror beroende på de experimentella förhållandena..
P4ELLER10 + 6 ROH → 2 (RO)tvåPO.OH + 2 RO.PO (OH)två
Med basiska oxider bildar det fasta fosfater.
Det är frätande. Kan reagera farligt med myrsyra och oorganiska baser såsom natriumhydroxid (NaOH), kalciumoxid (CaO) eller natriumkarbonat NatvåCO3.
Om du häller en lösning av perklorsyra HClO4 och kloroform CHCl3 i fosforoxid (v) P4ELLER10 en våldsam explosion inträffar.
Andra egenskaper
Det är inte brandfarligt. Det främjar inte förbränning. Emellertid är dess reaktion med vatten så våldsam och exoterm att det kan finnas risk för brand..
Erhållande
Det kan framställas genom direkt oxidation av fosfor i en ström av torr luft. Fosfor när det kommer i kontakt med överskott av syre oxiderar och bildar fosforoxid (v).
P4 + 5 Otvå → P4ELLER10
Närvaro i naturen
Fosfor (v) oxid finns i mineraler som ilmenit, rutil och zirkon.
Ilmenit är ett mineral som innehåller järn och titan och ibland har fosfor (v) oxid i koncentrationer som varierar mellan 0,04 och 0,33 viktprocent. Rutil är ett titanoxidmineral och kan innehålla cirka 0,02 viktprocent PtvåELLER5.
Zirkonsand (ett mineral av elementet zirkonium) har fosforoxid (v) i 0,05-0,39 viktprocent.
Applikationer
Som ett uttorknings- och torkmedel
På grund av dess stora girighet efter vatten är det ett av de mest kända uttorkningsmedlen och mycket effektivt vid temperaturer under 100 ° C..
Det kan extrahera vatten från ämnen som i sig anses uttorkande medel. Du kan till exempel ta bort vatten från svavelsyra HtvåSW4 förvandla det till SO3 och salpetersyra HNO3 förvandla den till NtvåELLER5.

I grund och botten kan den torka alla vätskor och gaser som den inte reagerar med, så det gör det möjligt att ta bort spår av fukt från vakuumsystem.
I organisk kemi reaktioner
Fosforoxid (v) tjänar till att stänga ringar av organiska föreningar och andra kondensationsreaktioner.
Det gör det möjligt att förestra organiska syror med möjlighet att skilja mellan primära alifatiska karboxylsyror (kolkedja utan ringar med -COOH-gruppen i ena änden) och aromatiska syror (-COOH-grupp fäst vid bensenringen), eftersom den senare inte reagerar.
Det tjänar också till att avlägsna en molekyl av HtvåO av amiderna R (C = O) NHtvå och omvandlar dem till R-CN-nitriler. Dessutom katalyserar eller påskyndar syresättning, dehydrogenering och polymerisationsreaktioner av bitumen.

I bränsleraffinering
Sedan 30-talet av 1900-talet visade vissa studier att fosfor (v) oxid utövade en raffineringsåtgärd på bensin, vilket ökade dess oktantal.
Raffineringsåtgärden hos P4ELLER10 det beror främst på kondensationsreaktioner (förening av olika molekyler) och inte polymerisation (förening av lika molekyler).
Sidan4ELLER10 accelererar den direkta alkyleringen av aromatiska kolväten med olefiner, omvandlingen av olefiner till naftener och deras partiella polymerisation. Alkyleringsreaktionen ökar oktantalet av bensin.
På detta sätt erhålls en högkvalitativ raffinerad bensin.

I olika applikationer
Fosforoxid (v) används för att:
- Bered fosforsyra H3PO4
- Skaffa akrylatestrar och tensider
- Förbered fosfatestrar som används som flamskyddsmedel, lösningsmedel och utspädningsmedel
- Omvandling av fosfortriklorid till fosforoxiklorid
- Laboratoriereagens
- Tillverkar specialglas för vakuumrör
- Öka smältpunkten för asfalt
- Servera som en standardmolekyl vid bestämning av fosfor eller fosfater i fosfatsten, gödselmedel och Portlandcement, i form av PtvåELLER5
- Förbättra bindningarna mellan vissa polymerer och det elfenbensskikt som tänderna har

Risker
Fosfor (v) oxid bör förvaras i slutna behållare och på svala, torra, väl ventilerade platser.
Detta syftar till att förhindra att det kommer i kontakt med vatten, eftersom det kan reagera våldsamt med det, generera mycket värme, så att det bränner närliggande material som är brännbara..
Fosfor (v) oxiddamm irriterar ögonen och andningsvägarna och frätar huden. Kan orsaka ögonbrännskador. Förtäring orsakar dödliga inre brännskador.
Referenser
- USA National Library of Medicine. (2019). Fosforsyraanhydrid. Återställd från pubchem.ncbi.nlm.nih.gov.
- Nayler, P. (2001). Bitumen: Modifierad. Kemisk modifiering. I Encyclopedia of Materials: Science and Technology. Återställd från sciencedirect.com.
- Malishev, B.W. (1936). Fosforpentoxid som raffineringsmedel för bensin. Industriell och teknisk kemi 1936, 28, 2, 190-193. Återställd från pubs.acs.org.
- Epps, Jr. E.A. (1950). Fotometrisk bestämning av tillgänglig fosforpentoxid i gödselmedel. Analytisk kemi 1950, 22, 8, 1062-1063. Återställd från pubs.acs.org.
- Banerjee, A. et al. (1983). Användning av fosforpentoxid: förestring av organiska syror. J. Org. Chem. 1983, 48, 3108-3109. Återställd från pubs.acs.org.
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjärde upplagan. John Wiley & Sons.
- Ogliari, F.A. et al. (2008). Syntes av fosfatmonomerer och bindning till dentin: Förestringsmetoder och användning av fosforpentoxid. Journal of Dentistry, Volym 36, utgåva 3, mars 2008, sidorna 171-177. Återställd från sciencedirect.com.



Ingen har kommenterat den här artikeln än.