
Järnoxidstruktur, egenskaper, nomenklatur, användningsområden
A järnoxid Det är någon av föreningarna som bildas mellan järn och syre. De kännetecknas av att de är joniska och kristallina och ligger utspridda som ett resultat av erosionen av deras mineraler, som komponerar jordarna, växtmassan och till och med det inre av levande organismer..
Det är då en av familjerna av föreningar som dominerar i jordskorpan. Vad exakt är de? Hittills är sexton järnoxider kända, de flesta av naturligt ursprung och andra syntetiserade under extrema förhållanden av tryck eller temperatur..

En del av pulveriserad järnoxid visas i bilden ovan. Dess karakteristiska röda färg täcker järn från olika arkitektoniska element i det som kallas rost. På samma sätt observeras det i sluttningarna, bergen eller marken blandat med många andra mineraler, såsom det gula pulveret av goetit (α-FeOOH).
De mest kända järnoxiderna är hematit (α-FetvåELLER3) och maghemit (ϒ- FetvåELLER3), båda polymorferna av järnoxid; och inte minst magnetit (Fe3ELLER4). Deras polymorfa strukturer och deras stora yta gör dem till intressanta material som sorbenter eller för syntes av nanopartiklar med breda tillämpningar..
Artikelindex
- 1 Struktur
- 1.1 Polymorfism
- 1.2 Strukturella länkar
- 2 fastigheter
- 3 Nomenklatur
- 3.1 Systematisk nomenklatur
- 3.2 Beståndsnomenklatur
- 3.3 Traditionell nomenklatur
- 4 användningsområden
- 4.1 Nanopartiklar
- 4.2 Pigment
- 5 Referenser
Strukturera
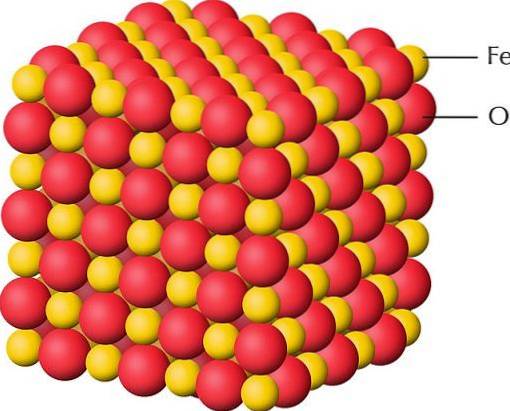
Den översta bilden är en representation av kristallstrukturen hos FeO, en av järnoxiderna där järn har en valens på +2. De röda sfärerna motsvarar anjonerna Otvå-, medan de gula till Fe-katjonernatvå+. Observera också att varje trotvå+ är omgiven av sex O: ertvå-, bildar en oktaedrisk enhet för samordning.
Därför kan FeO-strukturen "smulas" till enheter av FeO.6, där den centrala atomen är Fetvå+. När det gäller oxihydroxider eller hydroxider är den oktaedriska enheten FeO3(ÅH)3.
I vissa strukturer, i stället för oktaeder, finns det tetraedriska enheter, FeO4. Av denna anledning representeras strukturerna av järnoxider vanligtvis med oktaeder eller tetraeder med järncentra..
Strukturerna för järnoxider beror på förhållandena för tryck eller temperatur, på Fe / O-förhållandet (det vill säga hur många oxygener det finns per järn och vice versa) och på valens av järn (+2, +3 och, mycket sällan i syntetiska oxider, +4).
I allmänhet är de skrymmande anjonerna Otvå- är inriktade och bildar ark vars hål innehåller Fe-katjonernatvå+ o Tro3+. Således finns det oxider (som magnetit) som har järn med båda valenser.
Polymorfism
Järnoxider utgör polymorfism, det vill säga olika strukturer eller kristallarrangemang för samma förening. Järnoxid, FetvåELLER3, har upp till fyra möjliga polymorfer. Hematit, a-FetvåELLER3, det är det mest stabila av alla; följt av maghemiten, Fa- TrotvåELLER3, och av den syntetiska P-FetvåELLER3 och ε- FetvåELLER3.
De har alla sina egna typer av kristallstrukturer och system. Emellertid förblir förhållandet 2: 3 konstant, så det finns tre anjoner Otvå- för varannan Fe-katjon3+. Skillnaden ligger i hur FeO-oktaedriska enheter är placerade.6 i rymden och hur kommer ni samman.
Strukturella länkar

Octahedral enheter FeO6 kan ses med bilden ovan. I hörnen av oktaedronen är Otvå-, medan den är i sin trotvå+ o Tro3+(när det gäller FetvåELLER3). Sättet som dessa oktaeder är ordnade i rymden avslöjar oxidens struktur.
Men de påverkar också hur de är länkade. Till exempel kan två oktaedrar sammanfogas genom att röra vid två av deras hörn, vilket representeras av en syrebro: Fe-O-Fe. På samma sätt kan oktaedroner gå med genom sina kanter (intill varandra). Det skulle då representeras med två syrebryggor: Fe- (O)två-Tro.
Och slutligen kan oktahedra interagera genom deras ansikten. Således skulle representationen nu vara med tre syrebroar: Fe- (O)3-Fe. Sättet på vilket oktaedra är kopplade skulle variera de interkärniga avstånden Fe-Fe och därför de fysiska egenskaperna hos oxiden.
Egenskaper
En järnoxid är en förening med magnetiska egenskaper. Dessa kan vara anti-, ferro- eller ferrimagnetiska och beror på Fe-valenserna och hur katjonerna interagerar i det fasta ämnet..
Eftersom strukturerna hos fasta ämnen är mycket varierade, så är deras fysiska och kemiska egenskaper också.
Exempelvis polymorferna och hydraterna av FetvåELLER3 de har olika värden av smältpunkter (som sträcker sig mellan 1200 och 1600 ° C) och densiteter. De har emellertid gemensamt den låga lösligheten på grund av Fe3+, samma molekylvikt, är brun till färgen och löses sparsamt i syralösningar.
Nomenklatur
IUPAC fastställer tre sätt att namnge en järnoxid. Alla tre är mycket användbara, fastän för komplexa oxider (såsom Fe7ELLER9) de systematiska reglerna över de andra genom sin enkelhet.
Systematisk nomenklatur
Antalet syre och järn tas med i beräkningen och namnger dem med de grekiska numreringsprefixen mono-, di-, tri-, etc. Enligt denna nomenklatur har FetvåELLER3 heter: trioxid av gavjärn. Och för tron7ELLER9 dess namn skulle vara: icke-hepta-järnoxid.
Lagernomenklatur
Detta tar hänsyn till järnets valens. Om det handlar om trotvå+, järnoxid är skriven ... och dess valens med romerska siffror inneslutna inom parentes. För trontvåELLER3 dess namn är: järn (III) oxid.
Observera att Fe3+ kan bestämmas av algebraiska summor. Om Otvå- Det har två negativa laddningar, och det finns tre av dem, de uppgår till -6. För att neutralisera detta -6 krävs +6, men det finns två Fe, så de måste delas med två, + 6/2 = +3:
2X (metallvalens) + 3 (-2) = 0
Enkelt att lösa för X erhålls Fe-valens i oxiden. Men om X inte är ett heltal (som är fallet med nästan alla återstående oxider), så finns det en blandning av Fetvå+ och tro3+.
Traditionell nomenklatur
Suffixet -ico ges till prefixet ferr- när Fe har valens +3 och -oso när dess valens är 2+. Således är FetvåELLER3 det heter: järnoxid.
Applikationer
Nanopartiklar
Järnoxider har en hög kristallisationsenergi gemensamt, vilket gör det möjligt att skapa mycket små kristaller men med en stor yta..
Av denna anledning är de av stort intresse inom nanoteknikområdet, där de designar och syntetiserar oxidnanopartiklar (NP) för specifika ändamål:
-Som katalysatorer.
-Som en reservoar av läkemedel eller gener i kroppen
-I utformningen av sensoriska ytor för olika typer av biomolekyler: proteiner, sockerarter, fetter
-För att lagra magnetiska data
Pigment
Eftersom vissa oxider är mycket stabila kan de användas för att färga textilier eller ge ljusa färger på ytorna på vilket material som helst. Från mosaikerna på golven; röda, gula och orange (till och med gröna) färger; keramik, plast, läder och till och med arkitektoniska verk.
Referenser
- Förvaltare från Dartmouth College. (18 mars 2004). Stökiometri av järnoxider. Hämtad från: dartmouth.edu
- Ryosuke Sinmyo et al. (2016, 8 september). Upptäckten av Fe7ELLER9: en ny järnoxid med en komplex monoklinisk struktur. Återställd från: nature.com
- M. Cornell, U. Schwertmann. Järnoxiderna: struktur, egenskaper, reaktioner, förekomster och användningar. [PDF]. WILEY-VCH. Hämtad från: epsc511.wustl.edu
- Alice Bu. (2018). Järnoxid nanopartiklar, egenskaper och applikationer. Hämtad från: sigmaaldrich.com
- Ali, A., Zafar, H., Zia, M., ul Haq, I., Phull, A. R., Ali, J. S., & Hussain, A. (2016). Syntes, karakterisering, tillämpningar och utmaningar av järnoxid nanopartiklar. Nanoteknik, vetenskap och tillämpningar, 9, 49-67. http://doi.org/10.2147/NSA.S99986
- Golchha-pigment. (2009). Järnoxider: applikationer. Hämtad från: golchhapigments.com
- Kemisk formulering. (2018). Järn (II) oxid. Hämtad från: formulacionquimica.com
- Wikipedia. (2018). Järn (III) oxid. Hämtad från: https://en.wikipedia.org/wiki/Iron(III)_oxide



Ingen har kommenterat den här artikeln än.