
Jodhistoria, egenskaper, struktur, erhållande, risker, användningsområden
De jod Det är ett reaktivt icke-metalliskt element som tillhör grupp 17 i det periodiska systemet (halogener) och representeras av den kemiska symbolen I. I huvudsak är det ett ganska populärt element, från jodiserat vatten till hormonet tyrosin.
I fast tillstånd är jod mörkgrå med en metallisk glans (lägre bild), som kan sublimera för att producera en violett ånga som, när den kondenseras på en kall yta, lämnar en mörk rest. Många och attraktiva har varit experimenten för att demonstrera dessa egenskaper.

Detta element isolerades för första gången av Bernard Curtois år 1811 medan man erhöll föreningar som fungerade som råmaterial för tillverkning av saltpeter. Curtois identifierade emellertid inte jod som ett element, en förtjänst som delades av Joseph Gay-Lussac och Humphry Davy. Gay-Lussac identifierade elementet som "iod", en term som kom från det grekiska ordet "ioides" med vilken färgen violett betecknades..
Elementärt jod, liksom de andra halogenerna, är en diatomisk molekyl, som består av två jodatomer kopplade av en kovalent bindning. Van der Waals-interaktionen mellan jodmolekyler är den starkaste bland halogener. Detta förklarar varför jod är halogen med de högsta smält- och kokpunkterna. Dessutom är det den minst reaktiva av halogenerna och den med den lägsta elektronegativiteten..
Jod är ett väsentligt element som måste intas, eftersom det är nödvändigt för kroppstillväxt. hjärna och mental utveckling; metabolism i allmänhet, etc., rekommenderar ett dagligt intag av 110 µg / dag.
Jodbrist i fostertillståndet hos en person är förknippat med uppkomsten av kretinism, ett tillstånd som kännetecknas av långsam kroppstillväxt; samt otillräcklig mental och intellektuell utveckling, strabismus, etc..
Under tiden är en jodbrist i vilken ålder som helst hos individen associerad med en goiter, som kännetecknas av en hypertrofi i sköldkörteln. Goiter är en endemisk sjukdom, eftersom den är begränsad till vissa geografiska områden med sina egna näringsegenskaper.
Artikelindex
- 1 Historia
- 1.1 Upptäckt
- 1.2 Uppkomst av namnet
- 1.3 Historiska användningsområden
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Utseende
- 2.2 Standard atomvikt
- 2.3 Atomnummer (Z)
- 2.4 Smältpunkt
- 2.5 Kokpunkt
- 2.6 Densitet
- 2.7 Löslighet
- 2.8 Lukt
- 2.9 Fördelningskoefficient oktanol / vatten
- 2.10 Sönderdelning
- 2.11 Viskositet
- 2.12 Trippelpunkt
- 2.13 Kritisk punkt
- 2.14 Fusionsvärme
- 2.15 Förångningsvärme
- 2.16 Molär värmekapacitet
- 2.17 Ångtryck
- 2.18 oxidationsnummer
- 2.19 Elektronegativitet
- 2.20 Joniseringsenergi
- 2.21 Värmeledningsförmåga
- 2.22 Elektrisk motståndskraft
- 2.23 Magnetisk ordning
- 2.24 Reaktivitet
- 3 Struktur och elektronisk konfiguration
- 3.1 - Jodatom och dess bindningar
- 3.2 - Kristaller
- 3.3 - Faser
- 4 Var att hitta och få
- 4.1 Caliche
- 4.2 Saltlösningen
- 5 Biologisk roll
- 5.1 - Rekommenderad diet
- 5.2 - Sköldkörtelhormoner
- 5.3 - Brist
- 6 risker
- 7 användningsområden
- 7.1 Läkare
- 7.2 Reaktioner och katalytisk verkan
- 7.3 Fotografering och optik
- 7.4 Andra användningsområden
- 8 Referenser
Berättelse
Upptäckt
Jod upptäcktes av den franska kemisten Bernard Curtois år 1811 medan han arbetade med sin far i produktionen av saltpeter och krävde natriumkarbonat för detta..
Denna förening isolerades från tång som de samlade utanför Normandie och Bretagne. För detta ändamål brändes algerna och askan tvättades med vatten, vilket förstörde de resulterande resterna med tillsats av svavelsyra..
Vid ett tillfälle, kanske av ett oavsiktligt misstag, tillsatte Curtois ett överskott av svavelsyra och en lila ånga bildades som kristalliserade på de kalla ytorna och sedimenterade som mörka kristaller. Curtois misstänkte att han var i närvaro av ett nytt element och kallade det "Substance X".
Curtois upptäckte att detta ämne, när det blandades med ammoniak, bildade ett brunt fast ämne (kvävetriiodid) som exploderade vid minsta kontakt.
Curtois hade dock begränsningar för att fortsätta sin forskning och bestämde sig för att ge prover av sitt ämne till Charles Desormes, Nicolas Clément, Joseph Gay-Lussac och André-Marie Ampère för att få deras samarbete..
Namnets uppkomst
I november 1813 offentliggjorde Desormes och Clément Curtois upptäckt. I december samma år påpekade Gay-Lussac att det nya ämnet kan vara ett nytt element, vilket föreslår namnet "iode" från det grekiska ordet "ioides", utsedd för violett..
Sir Humphry Davy, som fick en del av provet som Curtois gav Ampère, experimenterade med provet och noterade en likhet med klor. I december 1813 deltog Royal Society of London i identifieringen av ett nytt element.
Även om en diskussion uppstod mellan Gay-Lussac och Davy om identifiering av jod, erkände de båda att Curtois var den första som isolerade det. År 1839 fick Curtois äntligen Montynpriset från Royal Academy of Sciences i erkännande av isoleringen av jod..
Historiska användningsområden
År 1839 gav Louis Daguerre jod sin första kommersiella användning och uppfann en metod för att producera fotografiska bilder som kallas daguerreotyper på tunna metallplåtar..
År 1905 undersökte den amerikanska patologen David Marine jodbrist vid vissa sjukdomar och rekommenderade intaget.
Fysiska och kemiska egenskaper
Utseende

Massiv mörkgrå med metallisk glans. När det är sublimerat är dess ångor lila i färg (toppbild).
Standard atomvikt
126,904 u
Atomnummer (Z)
53
Smältpunkt
113,7 ºC
Kokpunkt
184,3 ºC
Densitet
Omgivningstemperatur: 4,933 g / cm3
Löslighet
Den löser sig i vatten för att producera bruna lösningar med en koncentration på 0,03% vid 20 ºC..
Denna löslighet ökar avsevärt om det tidigare har upplösts jodidjoner, eftersom en jämvikt upprättas mellan I- och jagtvå för att bilda den anjoniska arten I3-, som solvaterar bättre än jod.
I organiska lösningsmedel som kloroform, koltetraklorid och koldisulfid, löser jod upp och ger en lila nyans. På samma sätt löser den sig i kväveföreningar, såsom pyridin, kinolin och ammoniak, för att bilda en brun lösning, återigen.
Skillnaden i färgningar ligger i det faktum att joden löses som solvatiserade molekyler Itvå, eller som lastöverföringskomplex; de senare dyker upp när de är polära lösningsmedel (vatten bland dem), som beter sig som Lewis-baser genom att donera elektroner till jod.
Odör
Skarp, irriterande och karakteristisk. Lukttröskel: 90 mg / m3 och irriterande luktgräns: 20 mg / m3.
Fördelningskoefficient oktanol / vatten
Logg P = 2,49
Sönderfall
Vid uppvärmning till sönderdelning avger den en rök av vätejodid och olika jodidföreningar..
Viskositet
2.27 cP vid 116 ºC
Trippel punkt
386,65 K och 121 kPa
Kritisk punkt
819 K och 11,7 MPa
Fusionsvärme
15,52 kJ / mol
Förångningsvärme
41,57 kJ / mol
Molär värmekapacitet
54,44 J / (mol K)
Ångtryck
Jod har ett måttligt ångtryck och när behållaren öppnas sublimerar den långsamt till en violett ånga, irriterande för ögon, näsa och hals..
Oxidationsnummer
Oxidationsnumren för jod är: -1 (I-), +1 (I+), +3 (I3+), +4 (I4+), +5 (I5+), +6 (I6+) och +7 (I7+). I alla jodidsalter, som i fallet med KI, har jod ett oxidationsnummer -1, eftersom vi i dem har anjonen I-.
Jod får positiva oxidationsnummer när det kombineras med element som är mer elektronegativa än det; till exempel i dess oxider (ItvåELLER5 och jag4ELLER9) eller interhalogenerade föreningar (I-F, I-Cl och I-Br).
Elektronnegativitet
2,66 på Pauling-skalan
Joniseringsenergi
Först: 1 008,4 kJ / mol
Andra: 1845 kJ / mol
Tredje: 3.180 KJ / mol
Värmeledningsförmåga
0,449 W / (m K)
Elektrisk resistans
1,39 107 Ω · m vid 0 ºC
Magnetisk ordning
Diamagnetisk
Reaktivitet
Jod kombineras med de flesta metaller för att bilda jodider, och även med icke-metalliska element som fosfor och andra halogener. Jodidjonen är ett starkt reduktionsmedel som spontant frigör en elektron. Oxidation av jod ger en brunaktig nyans av jod.
Jod, i motsats till jodid, är ett svagt oxidationsmedel; svagare än brom, klor och fluor.
Jod med oxidationsnummer +1 kan kombineras med andra halogener med oxidationsnummer -1 för att ge jodhalider; till exempel: jodbromid, IBr. På samma sätt kombinerar den med väte för att ge upphov till vätejodid, som efter upplösning i vatten kallas hydrojodsyra..
Hydrojodsyra är en mycket stark syra som kan bilda jodider genom reaktion med metaller eller deras oxider, hydroxider och karbonater. Jod har +5 oxidationstillstånd i jodsyra (HIO3), som dehydratiseras för att producera jodpentoxid (ItvåELLER5).
Struktur och elektronisk konfiguration
- Jodatom och dess bindningar

Jod i sitt marktillstånd består av en atom som har sju valenselektroner, bara en från att kunna slutföra sin oktett och bli isoelektronisk med ädelgas-xenon. Dessa sju elektroner är ordnade i sina 5s och 5p orbitaler enligt deras elektroniska konfiguration:
[Kr] 4d10 5stvå 5 s5
Därför visar jag atomer en stark tendens att binda kovalent så att var och en har åtta elektroner i sitt yttersta skal. Således närmar sig två I-atomer och bildar I-I-bindningen, som definierar den diatomiska molekylen Itvå (toppbild); molekylenhet jod i dess tre fysiska tillstånd under normala förhållanden.
Bilden visar molekyl Itvå representerad av en rumslig fyllnadsmodell. Det är inte bara en diatomär molekyl utan också homonukleär och apolär; så deras intermolekylära interaktioner (Itvå - Jagtvå) styrs av Londons dispersionskrafter, som är direkt proportionella mot deras molekylvikt och atomernas storlek.
Denna I-I-bindning är emellertid svagare jämfört med den för de andra halogenerna (F-F, Cl-Cl och Br-Br). Detta beror teoretiskt på den dåliga överlappningen av deras sp-hybridorbitaler3.
- Kristaller
Molekylmassan av Itvå låter dess dispersiva krafter vara riktade och starka nog för att upprätta en ortorombisk kristall vid omgivande tryck. Dess höga elektroninnehåll gör att ljuset främjar oändliga energiomgångar, vilket får jodkristallerna att fläcka svarta.
Men när jod sublimerar visar dess ångor en violett färg. Detta är redan ett tecken på en mer specifik övergång inom molekylära orbitaler av jagtvå (de med högsta energi eller anti-länk).
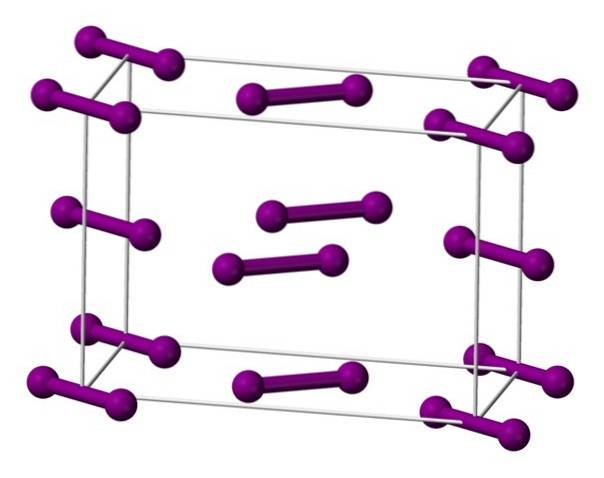
Molekyler I visas ovantvå, representerad av en modell av sfärer och staplar, ordnade i den ortorombiska enhetscellen.
Det kan ses att det finns två lager: det nedre med fem molekyler och det mittersta med fyra. Observera också att en jodmolekyl sitter vid basen av cellen. Glas byggs genom att regelbundet fördela dessa lager i alla tre dimensioner..
Genom att föra riktningen parallellt med I-I-bindningarna, har man funnit att jodorbitalerna överlappar varandra för att generera ett ledningsband, vilket gör detta element till en halvledare; emellertid försvinner dess förmåga att leda elektricitet om riktningen vinkelrätt mot skikten följs.
Länkavstånd
Jag-länken verkar ha expanderat; och faktiskt är det, eftersom längden på bindningen ökar från 266 pm (gasformigt tillstånd) till 272 pm (fast tillstånd).
Detta kan bero på det faktum att molekylerna I i gastvå de är väldigt långt ifrån varandra, deras intermolekylära krafter är nästan försumbar; medan i det fasta ämnet blir dessa krafter (I-I-I-I) påtagliga, attraherar jodatomerna från två angränsande molekyler mot varandra och följaktligen förkortar det intermolekylära avståndet (eller interatomiskt sett på ett annat sätt).
Sedan, när jodkristallen sublimerar, krymper I-I-bindningen i gasfasen, eftersom angränsande molekyler inte längre utövar samma (dispersiva) attraktiva kraft på sin omgivning. Och också logiskt sett avståndet jagtvå - Jagtvå ökar.
- Faser
Det nämndes tidigare att I-I-bindningen är svagare jämfört med de andra halogenerna. I gasfasen vid en temperatur av 575 ºC, 1% av molekylerna Itvå de bryts upp i enskilda I-atomer. Det finns så mycket värmeenergi att bara två jag har kommit ihop igen de separerar, och så vidare.
På liknande sätt kan detta bindningsbrott inträffa om enormt tryck appliceras på jodkristallerna. Genom att komprimera det för mycket (under tryck hundratusentals gånger högre än atmosfäriskt), molekylerna Itvå omarrangeras som en monatomisk fas I och jod sägs då uppvisa metalliska egenskaper.
Det finns dock andra kristallina faser, såsom: kroppscentrerad ortorombisk (fas II), kroppscentrerad tetragonal (fas III) och ansiktscentrerad kubisk (fas IV).
Var att hitta och få
Jod har ett viktförhållande, i förhållande till jordskorpan, på 0,46 ppm och rankas 61. i överflöd i det. Jodmineraler är knappa, och kommersiellt utnyttjbara jodavlagringar är jodater..
Jodmineraler finns i magmatiska bergarter med en koncentration på 0,02 mg / kg till 1,2 mg / kg och i magmatiska bergarter med en koncentration på 0,02 mg till 1,9 mg / kg. Det finns också i Kimmeridge-skiffer med en koncentration på 17 mg / kg vikt.
Vidare finns jodmineraler i fosfatstenar med en koncentration som sträcker sig från 0,8 till 130 mg / kg. Havsvatten har en jodkoncentration som varierar från 0,1 till 18 µg / L. Tång, svampar och ostron var tidigare de viktigaste källorna till jod.
För närvarande är dock de viktigaste källorna kaliche, natriumnitratfyndigheter i Atacama-öknen (Chile) och saltlake, huvudsakligen från det japanska gasfältet i Minami Kanto, öster om Tokyo, och gasfältet Anadarko. Handfat i Oklahoma (USA).
Caliche
Jod extraheras från caliche i form av jodat och behandlas med natriumbisulfit för att reducera det till jodid. Lösningen bringas sedan att reagera med nyligen extraherat jodat för att underlätta dess filtrering. Caliche var den viktigaste källan till jod under 1800- och början av 1900-talet..
Saltlösningen
Efter rening behandlas saltlösningen med svavelsyra, som producerar jodid..
Denna jodidlösning reageras därefter med klor för att producera en utspädd jodlösning, som avdunstas av en luftström som avleds till ett absorberande torn av svaveldioxid, vilket ger följande reaktion:
Jagtvå + 2 timmartvåO + SOtvå => 2 HI + HtvåSW4
Därefter reagerar vätejodidgasen med klor för att frigöra joden i gasform:
2 HI + Cltvå => Jagtvå + 2 HCl
Och slutligen filtreras, renas och förpackas joden för användning..
Biologisk roll
- Rekommenderad diet
Jod är ett viktigt element, eftersom det ingriper i många funktioner hos levande varelser, som är särskilt kända hos människor. Det enda sättet för jod att komma in i människan är genom maten han äter.
Den rekommenderade kosten för jod varierar med åldern. Således kräver ett 6 månader gammalt barn ett intag av 110 µg / dag; men från 14 års ålder är den rekommenderade kosten 150 µg / dag. Dessutom anges att jodintaget inte bör överstiga 1100 µg / dag.
- Sköldkörtelhormoner
Sköldkörtelstimulerande hormon (TSH) utsöndras av hypofysen och stimulerar upptagandet av jod av sköldkörteln. Jod transporteras in i sköldkörteln folliklar, känd som kolloider, där det binder till aminosyran tyrosin för att bilda monoiodotyrosin och diiodotyrosin..
I follikulär kolloid kombineras en molekyl av monoiodothyronine med en diiodothyronine-molekyl för att bilda en molekyl som kallas triiodothyronine (T3). Å andra sidan kan två molekyler av diiodotyrosin sammanfoga och bilda tetraiodotyronin (T4). T3 och T4 kallas sköldkörtelhormoner.
T-hormoner3 och t4 de utsöndras i plasma där de binder till plasmaproteiner; inklusive sköldkörtelhormontransportörprotein (TBG). De flesta av sköldkörtelhormonerna transporteras i plasma som T4.
Den aktiva formen av sköldkörtelhormoner är dock T3, så T4 i de "vita organen" i sköldkörtelhormonerna genomgår den avjodering och förvandlas till T3 för att utöva sin hormonella verkan.
Effekter redigera
Effekterna av sköldkörtelhormonernas verkan är flera, varvid följande är möjligt att påpeka: ökad ämnesomsättning och proteinsyntes; främjande av kroppstillväxt och hjärnans utveckling; ökat blodtryck och hjärtfrekvens etc..
- Brist
Bristen på jod och därför sköldkörtelhormoner, känd som hypotyreos, har många konsekvenser som påverkas av personens ålder.
Om jodbrist uppträder under en persons fostertillstånd är den mest relevanta konsekvensen kretinism. Detta tillstånd kännetecknas av tecken som nedsatt mental funktion, fördröjd fysisk utveckling, skelning och fördröjd sexuell mognad..
En jodbrist kan inducera en struma, oavsett i vilken ålder bristen uppstår. En struma är en överutveckling av sköldkörteln, orsakad av överdriven stimulering av körteln av hormonet TSH, som frigörs från hypofysen till följd av jodbrist..
Den överdrivna storleken på sköldkörteln (struma) kan komprimera luftröret och begränsa luftens passage genom den. Dessutom kan det orsaka skada på struphuvudna som kan leda till heshet..
Risker
Förgiftning från ett alltför stort intag av jod kan orsaka brännskador i mun, hals och feber. Även buksmärta, illamående, kräkningar, diarré, svag puls och koma.
Ett överskott av jod producerar några av de symtom som observerats vid en brist: det finns en hämning av syntesen av sköldkörtelhormoner, vilket ökar frisättningen av TSH, vilket resulterar i en hypertrofi av sköldkörteln; dvs. en struma.
Det finns studier som tyder på att överdrivet intag av jod kan orsaka tyreoidit och papillär sköldkörtelcancer. Dessutom kan ett alltför stort intag av jod interagera med mediciner, vilket begränsar deras verkan..
Överdrivet intag av jod i kombination med läkemedel mot sköldkörtel, såsom metimazol, som används för att behandla hypertyreoidism, kan ha en additiv effekt och orsaka hypotyreos..
Angiotensinomvandlande enzym (ACE) -hämmare, såsom benazepril, används för att behandla högt blodtryck. Att ta för mycket kaliumjodid ökar risken för hyperkalemi och högt blodtryck.
Applikationer
Läkare
Jod fungerar som ett desinfektionsmedel för huden eller såret. Den har nästan omedelbar antimikrobiell verkan, tränger in i det inre av mikroorganismer och interagerar med svavelaminosyror, nukleotider och fettsyror, vilket orsakar celldöd.
Det utövar sin antivirala verkan främst på de täckta virusen och postulerar att det attackerar proteinerna på ytan av de täckta virusen..
Kaliumjodid i form av en koncentrerad lösning används vid behandling av tyrotoxicos. Det används också för att kontrollera effekterna av strålning från 131Genom att blockera bindningen av den radioaktiva isotopen till sköldkörteln.
Jod används vid behandling av dendritisk keratit. För att göra detta utsätts hornhinnan för vattenångor mättade med jod, vilket tillfälligt förlorar hornhinnans epitel; men det är full återhämtning från det på två eller tre dagar.
Jod har också fördelaktiga effekter vid behandling av cystisk fibros i det mänskliga bröstet. Likaså har det påpekats att 131Jag kan vara en valfri behandling med sköldkörtelcancer.
Reaktioner och katalytisk verkan
Jod används för att detektera närvaron av stärkelse, vilket ger en blå nyans. Reaktionen av jod med stärkelse används också för att detektera närvaron av förfalskade sedlar tryckta på papper som innehåller stärkelse..
Kalium (II) tetraiodomercurate, även känt som Nesslers reagens, används vid detektion av ammoniak. På samma sätt används en alkalisk jodlösning i jodformtestet för att visa närvaron av metylketoner..
Oorganiska jodider används vid rening av metaller, såsom titan, zirkonium, hafnium och torium. I ett steg av processen måste tetraiodiderna av dessa metaller bildas.
Jod fungerar som en stabilisator för kolofonium, olja och andra träprodukter.
Jod används som en katalysator i de organiska syntesreaktionerna av metylering, isomerisering och dehydrogenering. Samtidigt används jodsyra som en katalysator för produktion av ättiksyra i Monsanto- och Cativa-processerna..
Jod fungerar som en katalysator vid kondensering och alkylering av aromatiska aminer, liksom vid sulfaterings- och sulfaneringsprocesser, och för produktion av syntetiska gummi.
Fotografi och optik
Silverjodid är en viktig del av traditionell fotografisk film. Jod används vid tillverkning av elektroniska instrument såsom enstaka kristallprismer, polariserande optiska instrument och glas som kan överföra infraröda strålar..
Andra användningsområden
Jod används vid tillverkning av bekämpningsmedel, anilinfärgämnen och ftalin. Dessutom används den vid syntes av färgämnen och är ett röksläckningsmedel. Och slutligen tjänar silverjodiden som en kondenseringskärna för vattenångan i molnen för att orsaka regn..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Stuart Ira Fox. (2003). Mänsklig psykologi. Första upplagan. Redigera. McGraw-Hill Interamericana
- Wikipedia. (2019). Jod. Återställd från: en.wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi & Onoda Mitsuko. (2003). Modulerad struktur av fast jod under dess molekylära dissociation under högt tryck. Naturvolym 423, sid.971-974. doi.org/10.1038/nature01724
- Chen L. et al. (1994). Strukturfasövergångar av jod vid högt tryck. Institutet för fysik, Academia Sinica, Peking. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider & Karl Christe. (26 augusti 2019). Jod. Encyclopædia Britannica. Återställd från: britannica.com
- Dr. Doug Stewart. (2019). Jodelement Fakta. Chemicool. Återställd från: chemicool.com
- Nationellt centrum för bioteknikinformation. (2019). Jod. PubChem-databas. CID = 807. Återställd från: pubchem.ncbi.nlm.nih.gov
- Rohner, F., Zimmermann, M., Jooste, P., Pandav, C., Caldwell, K., Raghavan, R., & Raiten, D. J. (2014). Biomarkörer för näring för utvärdering av jod. The Journal of nutrition, 144 (8), 1322S-1342S. doi: 10.3945 / jn.113.181974
- Advameg. (2019). Jod. Kemi förklaras. Återställd från: chemistryexplained.com
- Traci Pedersen. (19 april 2017). Fakta om jod. Återställd från: livescience.com
- Megan Ware, RDN, LD. (30 maj 2017). Allt du behöver veta om jod. Återställd från: medicalnewstoday.com
- National Institute of Health. (9 juli 2019). Jod. Återställd från: ods.od.nih.gov



Ingen har kommenterat den här artikeln än.