
Kaliumjodid (KI) struktur, egenskaper, erhållande, användningar, risker

De kaliumjodid är en oorganisk förening bildad av en kaliumjon (K+och en jodidjon (I-). Dess kemiska formel är KI. Det är ett vitt kristallint fast ämne, joniskt till sin natur och mycket lösligt i vatten..
KI gör det möjligt att genomföra olika kemiska reaktioner och analyser och används för att mäta mängden ozon i atmosfären. Används också i infraröd (IR) analysutrustning.

Kaliumjodid tillsätts till vanligt bordssalt för att förhindra jodbrist hos människor, eftersom detta kan vara ett allvarligt hälsoproblem.
Det används som ett slemlösande medel eftersom det hjälper slem att flyta lätt från andningskanalerna till utsidan. Det används också för att behandla vissa svampinfektioner och används i vissa kosmetika.
Det används av veterinärläkare för att bota djur med liknande problem som hos människor, såsom hosta och hudinfektioner. Det tillsätts till och med i mycket små mängder till djurfoder.
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Kokpunkt
- 3.5 Densitet
- 3.6 Löslighet
- 3,7 pH
- 3.8 Kemiska egenskaper
- 3.9 Andra egenskaper
- 4 Skaffa
- 5 användningsområden
- 5.1 Vid behandling av hypertyreoidism
- 5.2 I andra medicinska tillämpningar
- 5.3 I veterinärmedicinska tillämpningar
- 5.4 För att skydda sköldkörteln i radioaktiva nödsituationer
- 5.5 Vid mätningar av ozon i atmosfären
- 5.6 I olika användningsområden
- 6 risker
- 7 Referenser
Strukturera
Kaliumjodid är en jonförening bildad av kaliumkatjonen K+ och jodidanjonen I-, därför är bindningen mellan de två joniska. Oxidationstillståndet för kalium är +1 och jodens valens är -1.
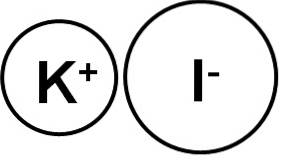
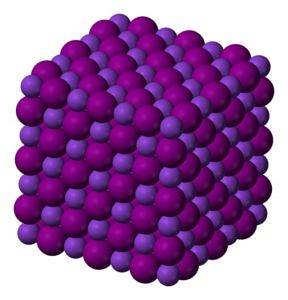
KI-kaliumjodidkristaller är kubiska.
Nomenklatur
- Kaliumjodid
- Kaliumjodid
Egenskaper
Fysiskt tillstånd
Färglös till vit kristallin fast substans. Kubiska kristaller.
Molekylvikt
166,003 g / mol
Smältpunkt
681 ºC
Kokpunkt
1323 ºC
Densitet
3,13 g / cm3
Löslighet
Mycket löslig i vatten: 149 g / 100 g vatten vid 25 ° C. Lätt löslig i etanol och eter.
pH
Dess vattenlösningar är neutrala eller alkaliska, med ett pH mellan 7 och 9.
Kemiska egenskaper
Något hygroskopisk i fuktig luft.
Den är stabil i torr luft. Ljus och fukt accelererar nedbrytningen och dess färg ändras till gult på grund av frisättningen av små mängder jod (Itvå) och jodater (IO3-).
Vattenhaltiga KI-lösningar blir också gula över tiden, men lite alkali kan förhindra detta.
Dessa lösningar löser jod (Itvå) ger KI3:
Jag- + Jagtvå → jag3-
Andra egenskaper
Den har en stark bitter och saltlösning. Det är inte brandfarligt.
Erhållande
Kaliumjodid kan erhållas genom upphettning av jod (Itvåi en koncentrerad lösning av kaliumhydroxid (KOH):
3 Itvå + 6 KOH → 5 KI + KIO3 + HtvåELLER
Den resulterande jodat- och jodidlösningen upphettas för att avlägsna vatten, reduceras till torrhet, kol tillsätts och upphettas till hög temperatur. Kol tar syre från jodat och oxiderar till koldioxid, vilket minskar jodat till jodid:
2 KIO3 + C → 2 KI + 3 COtvå
Den erhållna kaliumjodiden kan omkristalliseras för rening. Det vill säga, det löses upp igen i vatten och induceras att kristallisera igen..
Applikationer
Vid behandling av hypertyreoidism
Kaliumjodid fungerar som en ytterligare behandling tillsammans med andra medel mot sköldkörteln för att behandla hypertyreoidism.
Hypertyreoidism är en sjukdom som får sköldkörteln att producera för mycket sköldkörtelhormon, med en förstorad sköldkörtel, en viktminskning, en snabb hjärtslag och irritabilitet, bland andra symtom..
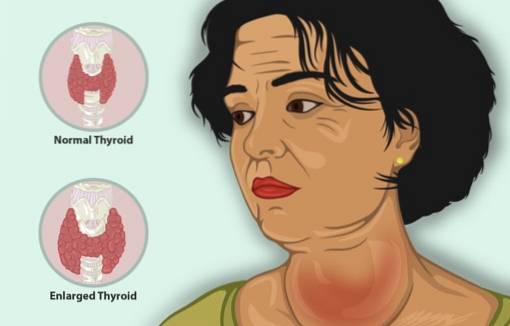
Hos patienter med hypertyreoidism minskar KI snabbt symtomen eftersom det hämmar frisättningen av sköldkörtelhormon.
Dess effekter på sköldkörteln är: minskning av antalet blodkärl i körteln, förstärkning av dess vävnader och minskning av storleken på dess celler.
Av denna anledning appliceras den som en preoperativ behandling för att inducera sköldkörtelns involvering eller minskning i storlek före en sköldkörtelektomi (avlägsnande av sköldkörteln) eftersom detta underlättar denna operation..
I andra medicinska tillämpningar
Kaliumjodid har slimlösande egenskaper eftersom det ökar utsöndringen av andningsvätskor, vilket resulterar i en minskning av slemviskositeten..

Det används för att behandla erytem nodosum, vilket är en smärtsam svullnad i benen där röda knölar bildas och en temperaturökning.
Det är ett antisvampmedel. Det möjliggör behandling av sporotrichos som är en hudinfektion orsakad av en svamp. Denna sjukdom händer för människor som arbetar med växter och jord, som jordbrukare och trädgårdsmästare..
Det används också vid behandling av jodbrist eller för att undvika det och därför tillsätts det till bordssalt eller ätbart salt (natriumklorid NaCl) som en jodkälla och ibland i dricksvatten.
I veterinärapplikationer
Kaliumjodid administreras till djur som ett antitussive, för att öka och vätska i vätskorna i andningsorganen, för kronisk bronkial hosta, liksom i fall av reumatism och som en antiinflammatorisk.
Det används också för mykos (svampinfektioner) hos djur, för att minska klåda och för kronisk förgiftning med bly eller kvicksilver.
För att skydda sköldkörteln i radioaktiva nödsituationer
Kaliumjodid har sköldkörtelskyddande egenskaper i händelse av att personen har utsatts för kärnstrålning.
KI översvämmar sköldkörteln med icke-radioaktivt jod vilket blockerar upptagningen av radioaktiva molekyler och absorptionen av radioaktivt jod, vilket skyddar sköldkörteln från cancer som strålning kan orsaka..
Vid mätningar av ozon i atmosfären
Ozongas (O3) kan mätas i atmosfären med hjälp av elektrolytiska celler som kallas ozonesondes, som bärs av radiosonde ballonger.
Dessa elektrolytiska celler innehåller en KI-kaliumjodidlösning. Celler är ursprungligen i kemisk och elektrisk jämvikt.
När ett ozonluftprov (O3) tränger igenom en av cellerna bryts jämvikten eftersom följande reaktion inträffar:
2 KI + O3 + HtvåO → Itvå + ELLERtvå + 2 KOH
Denna reaktion producerar en elektrisk ström som flyter mellan cellerna..
Den producerade mängden elektrisk ström överförs kontinuerligt av radiovågor till en station på marken. På detta sätt erhålls ozonprofilen från marken till kulans höjd..

I olika användningsområden
Kaliumjodid tillåter också:
- Eliminering av fria radikaler, såsom hydroxylradikalen OH.
- Tillverkning av fotografiska emulsioner för att fälla ut silver.
- Förbättra djurfoder genom att tillsättas i mikromängder.
- Deodorisera husdjursgödsel.
- Överför ljuset från det infraröda spektrumet i IR-analysutrustning.
- Utför vissa kemiska reaktioner och analyser i kemilaboratorier.
- Använd den i personliga hygienprodukter.
- Utför analys av miljöföroreningar.
Risker
Vissa personer som är känsliga för jodider bör ta det med försiktighet eftersom det kan orsaka jodism eller kronisk jodförgiftning, till exempel de med en autoimmun sköldkörtelsjukdom..
Personer med tuberkulos eller akut bronkit bör också vara försiktiga.
KI kan orsaka mjukning av spottkörtlarna, det kan bränna munnen eller halsen, ovanlig ökning av saliv, tandvärk och tandköttinflammation och metallsmak, bland andra symtom..
Det kan också irritera ögonen och öppna sår på huden..
Referenser
- USA National Library of Medicine. (2019). Kaliumjodid. Återställd från pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjärde upplagan. John Wiley & Sons.
- Dean, J.A. (redaktör). (1973). Lange's Handbook of Chemistry. Elfte upplagan. McGraw-Hill Book Company.
- Valkovic, V. (2019). Dekontaminering efter strålningsexponering. De mest känsliga kroppsdelarna. In Radioactivity in the Environment (andra upplagan). Återställd från sciencedirect.com.
- Smit, H.G.J. (2015). Atmosfärens kemi-observationer för kemi (in situ). I Encyclopedia of Atmospheric Sciences (andra upplagan). Återställd från sciencedirect.com.
- Muralikrishna, I.V. och Manickam, V. (2017). Analytiska metoder för övervakning av miljöföroreningar. I miljöledning. Återställd från sciencedirect.com.
- Wallace, J.M. och Hobbs, P.V. (2006). Atmospheric Chemistry 1. In Atmospheric Science (andra upplagan). Återställd från sciencedirect.com.



Ingen har kommenterat den här artikeln än.