
Acetonitril (C2H3N) Struktur, egenskaper, användningsområden
De acetonitril Det är ett ämne av organiskt ursprung som endast består av kol, väte och kväve. Denna kemiska art tillhör gruppen nitriler, med acetonitril som är den med den enklaste strukturen bland de av den organiska typen..
Nitriler är en klass av kemiska föreningar vars struktur består av en cyanidgrupp (CN-) och en radikal kedja (-R). Dessa element representeras av följande allmänna formel: R-C3N.
Det är känt att detta ämne huvudsakligen har sitt ursprung i produktionen av en annan art som kallas akrylnitril (en annan enkel nitril, med molekylformel C3H3N, som används vid tillverkning av produkter inom textilindustrin) som en biprodukt av samma.
Dessutom betraktas acetonitril som ett lösningsmedel med medel polaritetsegenskaper, varför det används ganska regelbundet i RP-HPLC (omvänd fas högpresterande vätskekromatografi) analyser..
Artikelindex
- 1 Struktur
- 2 fastigheter
- 3 användningsområden
- 4 risker
- 5 Referenser
Strukturera
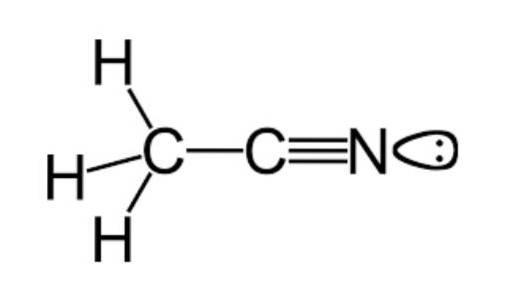
Som tidigare nämnts tillhör acetonitril den funktionella gruppen nitriler med en molekylformel som vanligen representeras som CtvåH3N, vilket kan ses i strukturformeln som exemplifieras i den övre figuren.
Denna bild visar ett slags lob fäst vid kväveatomen, vilket representerar paret av oparade elektroner som denna atom har, och som ger den en stor del av de reaktivitets- och stabilitetsegenskaper som är karakteristiska för den..
På detta sätt visar denna art ett mycket särskilt beteende på grund av dess strukturella arrangemang, vilket översätts till svaghet för att ta emot vätebindningar och liten förmåga att donera elektroner..
Detta ämne har också sitt ursprung för första gången under andra hälften av 1840-talet och tillverkas av forskaren vid namn Jean-Baptiste Dumas, vars nationalitet var fransk.
Den strukturella konformationen av detta ämne gör det möjligt att ha egenskaperna hos sitt eget lösningsmedel av organisk natur..
I sin tur tillåter denna egenskap acetonitril att blandas med vatten, liksom en serie andra lösningsmedel av organiskt ursprung, med undantag av kolväten eller mättade kolvätearter..
Egenskaper
Denna förening har en serie egenskaper som skiljer den från andra av samma klass, som listas nedan:
- Det är i flytande aggregeringstillstånd under standardförhållanden för tryck och temperatur (1 atm och 25 ° C).
- Dess molekylära konfiguration ger den en molmassa eller molekylvikt på cirka 41 g / mol.
- Det anses vara den nitril som har den enklaste strukturen, bland den organiska typen.
- Dess optiska egenskaper gör att den kan vara färglös i denna flytande fas och med feta egenskaper, förutom att den har en aromatisk lukt..
- Den har en flampunkt på cirka 2 ° C, vilket motsvarar 275,1 K eller 35,6 ° F.
- Den har en kokpunkt i intervallet 81,3 till 82,1 ° C, en densitet av cirka 0,786 g / cm3 och en smältpunkt som ligger mellan -46 och -44 ° C.
- Det är mindre tätt än vatten men blandbart med det och med en mängd olika organiska lösningsmedel.
- Den uppvisar en dielektrisk konstant på 38,8 förutom ett dipolmoment på cirka 3,92 D.
- Den kan lösa upp en mängd olika ämnen av joniskt ursprung och icke-polär natur.
- Det används ofta som en mobil fas i HPLC-analys, som har höga antändbarhetsegenskaper.
Applikationer
Bland det stora antalet applikationer som acetonitril har kan följande räknas:
- På liknande sätt kan andra arter av nitriler genomgå en metaboliseringsprocess i mikrosomer (vesikulära element som ingår i levern), speciellt i detta organ, för att producera hydrocyansyra..
- Det används ofta som en mobil fas i den typ av analys som kallas omvänd fas högpresterande vätskekromatografi (RP-HPLC); som ett eluerande ämne som har hög stabilitet, stor elueringsförmåga och låg viskositet.
- Vid applikationer av industriell storlek används denna kemiska förening i råoljeraffinaderier som lösningsmedel i vissa processer, såsom rening av den alken som kallas butadien..
- Det används också som en ligand (kemisk art som kombineras med en atom av ett metallelement, som anses vara centralt i den givna molekylen, för att bilda en förening eller koordinationskomplex) i ett stort antal nitrilföreningar med metaller i övergångsgruppen.
- På liknande sätt används den vid organisk syntes för ett stort antal sådana fördelaktiga kemikalier som a-naftalenättiksyra, tiamin eller acetamidinhydroklorid..
Risker
Riskerna med exponering för acetonitril är olika. Bland dessa är en minskad toxicitet när exponeringen är under en reducerad tidsperiod och i låga mängder, som metaboliseras för produktion av hydrocyansyra..
Likaså har det sällan förekommit fall av personer som har förgiftats med denna kemiska art, som förgiftats av cyaniden i molekylen efter att ha varit i kontakt med acetonitril i olika grader (vid inandning, intag eller upptagning genom huden).
Av denna anledning fördröjs konsekvenserna av dess toxicitet eftersom kroppen inte lätt metaboliserar detta ämne till cyanid, eftersom det tar två till tolv timmar innan detta inträffar..
Acetonitril absorberas emellertid lätt från lungorna och mag-tarmkanalen. Därefter sker dess fördelning i hela kroppen, händer hos människor och till och med hos djur och når njurarna och mjälten..
Å andra sidan är acetonitril, förutom de brandfarlighetsrisker det utgör, en föregångare till ämnen som är så giftiga som hydrocyansyra eller formaldehyd. Dess användning i produkter som tillhör det kosmetiska området var till och med förbjudet i det så kallade Europeiska ekonomiska samarbetsområdet 2000..
Referenser
- Wikipedia. (s.f.). Acetonitril. Hämtad från en.wikipedia.org
- PubChem. (s.f.). Acetonitril. Återställd från pubchem.ncbi.nlm.nih.gov
- Brown, P. R. (2000). Framsteg inom kromatografi. Erhålls från books.google.co.ve
- ScienceDirect. (s.f.). Acetonitril. Hämtad från sciencedirect.com
- ChemSpider. (s.f.). Acetonitril. Hämtad från chemspider.com



Ingen har kommenterat den här artikeln än.