
Elektronisk affinitetsvariation i periodiskt system och exempel
De Elektronisk samhörighet eller elektroaffinitet är ett mått på en atoms energiska variation i gasfasen när den införlivar en elektron i sitt valensskal. När elektronen har förvärvats av atom A, den resulterande anjonen A- det kan eller inte kan vara mer stabilt än ditt baslinjetillstånd. Därför kan denna reaktion vara endoterm eller exoterm..
Enligt konvention tilldelas elektronaffinitetsvärdet ett positivt tecken "+" när elektronförstärkningen är endoterm. Å andra sidan, om det är exotermiskt - det vill säga det frigör energi - får detta värde ett negativt tecken "-". I vilka enheter uttrycks dessa värden? I kJ / mol, eller i eV / atom.
Om elementet befann sig i en flytande eller fast fas skulle dess atomer interagera med varandra. Detta skulle medföra att den absorberade eller frigjorda energin, på grund av den elektroniska förstärkningen, skulle spridas mellan alla dessa och ge opålitliga resultat..
Å andra sidan antas de vara isolerade i gasfasen; med andra ord interagerar de inte med någonting. Så de atomer som är involverade i denna reaktion är: A (g) och A.-(g). Här (g) betecknar att atomen är i gasfasen.
Artikelindex
- 1 Första och andra elektroniska tillhörigheter
- 1.1 Först
- 1.2 Andra
- 2 Hur elektronaffinitet varierar i det periodiska systemet
- 2.1 Variation med kärnan och avskärmningseffekten
- 2.2 Variation med elektronkonfiguration
- 3 Exempel
- 3.1 Exempel 1
- 3.2 Exempel 2
- 4 Referenser
Första och andra elektroniska affiniteter
Först
Den elektroniska förstärkningsreaktionen kan representeras som:
A (g) + e- => A-(g) + E, eller som A (g) + e- + E => A-(g)
I den första ekvationen finns E (energi) som en produkt på vänster sida av pilen; och i den andra ekvationen räknas energin som reaktiv och ligger på höger sida. Det vill säga den första motsvarar en exoterm elektronisk förstärkning och den andra en endoterm elektronisk förstärkning.
I båda fallen är det dock bara en elektron som läggs till valensskalet av atom A..
Andra
Det är också möjligt att, när den negativa jonen A har bildats-, den absorberar en annan elektron igen:
TILL-(g) + e- => Atvå-(g)
Värdena för den andra elektronaffiniteten är emellertid positiva, eftersom de elektrostatiska avstötningarna mellan den negativa jonen A måste övervinnas- och den inkommande elektronen e-.
Vad bestämmer att en gasformig atom bättre "tar emot" en elektron? Svaret finns i huvudsak i kärnan, i skärmningseffekten av de inre elektroniska skikten och i valensskiktet.
Hur elektronaffinitet varierar i det periodiska systemet
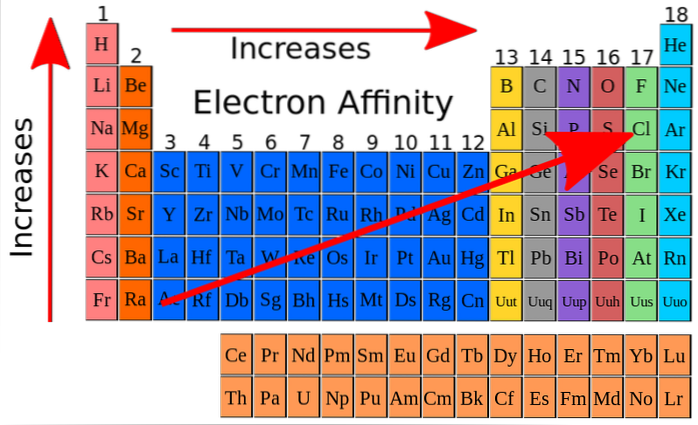
I den övre bilden indikerar de röda pilarna riktningarna i vilken elementens elektroniska affinitet ökar. Från detta kan elektronaffinitet förstås som en av de periodiska egenskaperna, med den särdrag att den ger många undantag..
Elektronaffinitet ökar stigande genom grupperna och ökar också från vänster till höger längs det periodiska systemet, särskilt i närheten av fluoratomen. Denna egenskap är nära besläktad med atomradien och energinivåerna i dess orbitaler..
Variation efter kärna och avskärmningseffekt
Kärnan har protoner, som är positivt laddade partiklar som utövar en attraktiv kraft på elektronerna i atomen. Ju närmare elektronerna är kärnan, desto större attraktion känner de. Således, när avståndet från kärnan till elektronerna ökar, desto mindre blir de attraktiva krafterna..
Dessutom hjälper elektronerna i det inre skalet att "skydda" kärnans effekt på elektronerna i de yttersta skalen: valenselektronerna..
Detta beror på de elektroniska avstängningarna mellan deras negativa laddningar. Denna effekt motverkas dock genom att öka atomnumret Z.
Hur relaterar ovanstående sig till elektronisk affinitet? Att en gasformig atom A har en större tendens att få elektroner och bilda stabila negativa joner när skärmningseffekten är större än avstötningarna mellan den inkommande elektronen och valensskalets.
Motsatsen inträffar när elektronerna är mycket långt från kärnan och avstötningarna mellan dem undergräver inte den elektroniska förstärkningen..
Till exempel, att gå ner i en grupp "öppnar" nya energinivåer, vilket ökar avståndet mellan kärnan och externa elektroner. Det är av den anledningen att när de stiger upp genom grupperna ökar de elektroniska affiniteterna.
Variation med elektronkonfiguration
Alla orbitaler har sina energinivåer, så om den nya elektronen kommer att uppta en orbital med högre energi måste atomen absorbera energi för att detta ska vara möjligt..
Dessutom kan det sätt på vilket elektroner ockuperar orbitalerna, eller inte, gynna elektronisk förstärkning och därmed skilja skillnader mellan atomer..
Till exempel, om alla elektroner är oparade i p-orbitalerna, kommer införandet av en ny elektron att orsaka bildandet av ett parat par, som utövar avstötande krafter på de andra elektronerna..
Detta är fallet för kväveatomen, vars elektronaffinitet (8kJ / mol) är lägre än för kolatomen (-122kJ / mol).
Exempel
Exempel 1
Den första och andra elektroniska affiniteten för syre är:
O (g) + e- => O-(g) + (141 kJ / mol)
ELLER-(g) + e- + (780 kJ / mol) => Otvå-(g)
Elektronkonfigurationen för O är 1stvå2stvå2 s4. Det finns redan ett parpar av elektroner som inte kan övervinna kärnans attraktiva kraft; därför frigör den elektroniska förstärkningen energi efter att den stabila O-jonen bildats.-.
Men även om Otvå- Den har samma konfiguration som ädelgasneonet, dess elektroniska avstötningar överskrider kärnans attraktiva kraft, och för att möjliggöra elektronens inträde krävs ett energibidrag.
Exempel 2
Om de elektroniska affiniteterna för elementen i grupp 17 jämförs, kommer följande att erhållas:
F (g) + e- = F-(g) + (328 kJ / mol)
Cl (g) + e- = Cl-(g) + (349 kJ / mol)
Br (g) + e- = Br-(g) + (325 kJ / mol)
I (g) + e- = Jag-(g) + (295 kJ / mol)
Från topp till botten - nedåt i gruppen - ökar atomradierna, liksom avståndet mellan kärnan och de yttre elektronerna. Detta orsakar en ökning av elektroniska affiniteter; emellertid överträffas fluor, som bör ha det högsta värdet, av klor.
Varför? Denna anomali visar effekten av elektroniska avstötningar på den attraktiva kraften och den låga skärmen..
Eftersom det är en mycket liten atom "kondenserar" fluor alla sina elektroner i en liten volym, vilket orsakar en större avstötning på den inkommande elektronen, till skillnad från dess mer voluminösa kongener (Cl, Br och I)..
Referenser
- Kemi LibreTexts. Elektronaffinitet. Hämtad den 4 juni 2018 från: chem.libretexts.org
- Jim Clark. (2012). Elektronaffinitet. Hämtad den 4 juni 2018 från: chemguide.co.uk
- Carl R. Nave. Elektronaffiniteter i huvudgruppens element. Hämtad den 4 juni 2018 från: hyperphysics.phy-astr.gsu.edu
- Prof. N. De Leon. Elektronaffinitet. Hämtad den 4 juni 2018 från: iun.edu
- Helmenstine, Anne Marie, Ph.D. (27 maj 2016). Definition av elektronaffinitet. Hämtad den 4 juni 2018 från: thoughtco.com
- Cdang. (3 oktober 2011). Periodiskt system för elektronaffinitet. [Figur]. Hämtad den 4 juni 2018 från: commons.wikimedia.org
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan). CENGAGE Learning, s 227-229.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan., S. 29). Mc Graw Hill.



Ingen har kommenterat den här artikeln än.