
Linjär alkanstruktur, egenskaper, nomenklatur, exempel
De linjära alkaner är mättade kolväten vars allmänna kemiska formel är n-CnH2n + 2. Eftersom de är mättade kolväten är alla deras bindningar enkla (C-H) och består endast av kol- och väteatomer. De kallas också paraffiner, vilket skiljer dem från grenade alkaner, som kallas isoparaffiner..
Dessa kolväten saknar grenar och ringar. Mer än linjer, denna familj av organiska föreningar är mer som kedjor (rak kedja alkan); eller från en kulinarisk vinkel till spagetti (rå och kokta).

Rå spagetti representerar det ideala och isolerade tillståndet för linjära alkaner, men med en uttalad tendens att bryta; medan de kokta, oavsett om de är al dente eller inte, närmar sig deras naturliga och synergistiska tillstånd: vissa interagerar med andra i en helhet (pastarätterna, till exempel).
Dessa typer av kolväten finns naturligt i naturgas och i oljefält. De lättaste har smörjegenskaper, medan de tunga beter sig som en oönskad asfalt; lösligt i paraffiner. De fungerar mycket bra som lösningsmedel, smörjmedel, bränslen och asfalt.
Artikelindex
- 1 Struktur av linjära alkaner
- 1.1 Grupper
- 1.2 Längderna på dina kedjor
- 1.3 Konformationer
- 2 fastigheter
- 2.1 Fysisk
- 2.2 Interaktioner
- 2.3 Stabilitet
- 3 Nomenklatur
- 4 Exempel
- 5 Referenser
Struktur av linjära alkaner
Grupper
Det nämndes att den allmänna formeln för dessa alkaner är CnH2n + 2. Denna formel är densamma för alla alkaner, oavsett om de är linjära eller grenade. Skillnaden då i n- som går före formeln för alkan, vars beteckning betyder "normal".
Det kommer att ses senare att detta n- det är onödigt för alkaner med ett koltal lika med eller mindre än fyra (n ≤ 4).
En linje eller kedja kan inte bestå av en enda kolatom, så metan (CH4, n = 1). Om n = 2 har vi etan, CH3-CH3. Observera att denna alkan består av två metylgrupper, CH3, länkade ihop.
Genom att öka antalet kol, n = 3, får alkanen propan, CH3-CHtvå-CH3. Nu visas en ny grupp, CHtvå, kallas metylen. Oavsett hur stor den linjära alkan är, kommer den alltid att ha bara två grupper: CH3 och CHtvå.
Kedjans längder
När n eller antalet kol i den linjära alkanen ökar finns det en konstant i alla resulterande strukturer: antalet metylengrupper ökar. Antag till exempel linjära alkaner med n = 4, 5 och 6:
CH3-CHtvå-CHtvå-CH3 (n-butan)
CH3-CHtvå-CHtvå-CHtvå-CH3 (n-pentan)
CH3-CHtvå-CHtvå-CHtvå-CHtvå-CH3 (n-hexan)
Kedjorna blir längre eftersom de lägger till CH-grupper i sina strukturertvå. Således skiljer sig en lång eller kort linjär alkan med hur många CHtvå separerar de två terminalgrupperna CH3. Alla dessa alkaner har bara två av dessa CH3: i början av strängen och i slutet av den. Om jag hade mer skulle det innebära att det finns grenar.
Likaså kan den totala frånvaron av CH-grupper ses, endast närvarande i grenarna eller när det finns substituentgrupper kopplade till ett av kedjorna i kedjan.
Strukturformeln kan sammanfattas enligt följande: CH3(CHtvå)n-2CH3. Försök att applicera och illustrera det.
Konformationer
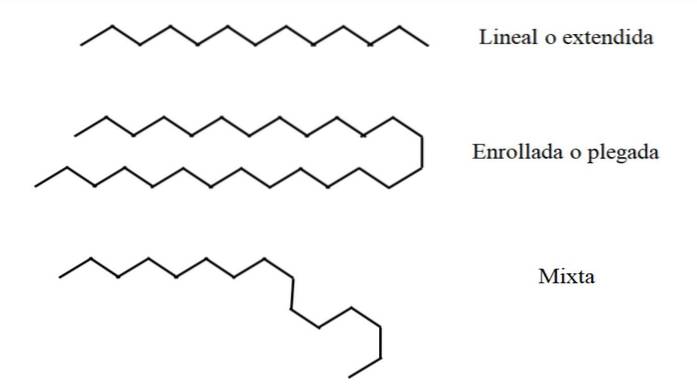
Vissa linjära alkaner kan vara längre eller kortare än andra. I detta fall kan n ha ett värde på 2 a ∞; det vill säga en kedja som består av oändliga CH-gruppertvå och två CH-grupper3 terminaler (teoretiskt möjligt). Men inte alla strängar "ryms" på samma sätt i rymden..
Det är här som de strukturella konformationerna för alkaner uppstår. Vad de är skyldiga? Till rotationsförmågan hos C-H-bindningarna och deras flexibilitet. När dessa länkar roterar eller roterar runt en kärnaxel börjar kedjorna att böjas, vikas eller lindas och rör sig bort från sin ursprungliga linjära karaktäristik..
Linjär
I den övre bilden visas till exempel en tretton-kolkedja längst upp som förblir linjär eller utsträckt. Denna konformation är ideal, eftersom det antas att den molekylära miljön minimalt påverkar det rumsliga arrangemanget av atomerna i kedjan. Ingenting stör henne och hon behöver inte böja sig.
Upprullad eller vikad
Mitt i bilden upplever 27-kolkedjan en yttre störning. Strukturen, för att vara mer "bekväm", roterar sina länkar på ett sådant sätt att den fälls på sig själv; precis som en lång spagetti.
Beräkningsstudier visade att det maximala antalet kol som en linjär kedja kan ha är n = 17. Från n = 18 är det omöjligt att det inte börjar böjas eller rullas.
Blandad
Om kedjan är mycket lång kan det finnas områden i kedjan som förblir linjära medan andra har böjts eller lindats. Av alla är detta kanske den närmaste verkligheten.
Egenskaper
Fysisk
Eftersom de är kolväten är de i huvudsak apolära och därför hydrofoba. Detta innebär att de inte kan blanda sig med vatten. De är inte så täta eftersom deras kedjor lämnar för många tomma utrymmen mellan sig.
På samma sätt varierar deras fysiska tillstånd från gasformiga (för n < 5), líquidos (para n < 13) o sólidos (para n ≥ 14), y dependen de la longitud de la cadena.
Interaktioner
Molekylerna av linjära alkaner är apolära och därför är deras intermolekylära krafter av Londons spridningstyp. Kedjorna (antagligen antagande en blandad konformation) lockas sedan av deras molekylmassas verkan och de momentana inducerade dipolerna av deras väte- och kolatomer..
Det är av den anledningen att när kedjan blir längre och därmed tyngre ökar dess kok- och smältpunkter på samma sätt..
Stabilitet
Ju längre kedjan desto mer instabil är den. De bryter vanligtvis sina länkar för att göra mindre kedjor från en stor. I själva verket är denna process känd som krackning, används mycket i oljeraffinering.
Nomenklatur
För att namnge linjära alkaner, lägg bara till n- indikatorn före namnet. Om n = 3, som med propan, är det omöjligt för denna alkan att presentera någon förgrening:
CH3-CHtvå-CH3
Vilket inte händer efter n = 4, det vill säga med n-butan och de andra alkanerna:
CH3-CHtvå-CHtvå-CH3
ELLER
(CH3)tvåCH-CH3
Den andra strukturen motsvarar isobutan, som består av en strukturell isomer av butan. För att skilja varandra från varandra, spelar n-indikatorn in. Således är den n-butan avser endast linjär isomer utan grenar.
Ju högre n, desto större är antalet strukturella isomerer och desto viktigare blir det att använda n- för att hänvisa till den linjära isomeren.
Till exempel oktan, C8H18 (C8H8 × 2 + 2), har upp till tretton strukturella isomerer, eftersom många grenar är möjliga. Den linjära isomeren heter emellertid: n-oktan, och dess struktur är:
CH3-CHtvå-CHtvå-CHtvå-CHtvå-CHtvå-CHtvå-CH3
Exempel
De nämns nedan och för att avsluta några linjära alkaner:
-Etan (CtvåH6CH: CH3CH3
-Propan (C3H8): CH3CHtvåCH3
-n-Heptan (C7H16): CH3(CHtvå)5CH3.
- n-Dean (C10H22CH: CH3(CHtvå)8CH3.
-n-Hexadekan (C16H3. 4CH: CH3(CHtvå)14CH3.
-n-Nonadecane (C19H40): CH3(CHtvå)17CH3.
-n-Eikosan (CtjugoH42): CH3(CHtvå)18CH3.
- n-Hektan (C100H202): CH3(CHtvå)98CH3.
Referenser
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Morrison, R. T. och Boyd, R, N. (1987). Organisk kemi. (5: e upplagan). Ledare Addison-Wesley Interamericana.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley plus.
- Jonathan M. Goodman. (1997). Vad är den längsta ogrenade filmen med en linjär global minimikonformation? J. Chem. Inf. Beräkning. Sci. 1997, 37, 5, 876-878.
- Garcia Nissa. (2019). Vad är alkaner? Studie. Återställd från: study.com
- Herr Kevin A. Boudreaux. (2019). Alkaner. Återställd från: angelo.edu
- Lista över rakkedjiga Alkenes. [PDF]. Återställd från: laney.edu
- Helmenstine, Anne Marie, Ph.D. (7 september 2018). Namn de första 10 alkanerna. Återställd från: thoughtco.com
- Quirky Science. (20 mars 2013). Raka kedjealkaner: förutsägande egenskaper. Återställd från: quirkyscience.com
- Wikipedia. (2019). Högre alkaner. Återställd från: en.wikipedia.org



Ingen har kommenterat den här artikeln än.