
Isoamylalkoholstruktur, egenskaper, användningar och risker
De isoamylalkohol är en organisk förening vars formel är (CH3)tvåCHCHtvåCHtvåÅH. Kemiskt sett är det en grenad primäralkohol och utgör en av isomererna av pentanol, kallade amylalkoholer5H12ELLER).
Liksom många alkoholer med låg molekylvikt är det en färglös vätska vid rumstemperatur. Detta möjliggör och underlättar dess användning som lösningsmedel för olika applikationer; ännu mer, när det inte utövar för många negativa effekter på ekosystemet efter att ha kasserats.
Även om det är ett mellanliggande material i syntesen av amylacetat för framställning av konstgjorda banandoftar, är dess egen lukt obehaglig och liknar den hos päron..
Förutom att fungera som ett lösningsmedel för flera biologiska ämnen och som en mellanprodukt vid syntesen av andra acetater, minskar det ytspänningen hos vissa industriella formuleringar, vilket förhindrar bildning av skum. Därför används den i mikroemulgerade system.
När det gäller dess naturliga ursprung har isoamylalkohol hittats i feromonerna på bålgetingar och i svarta tryffel, en typ av svampar som ligger i sydöstra Europa..
Artikelindex
- 1 Struktur av isoamylalkohol
- 1.1 Intermolekylära interaktioner
- 2 fastigheter
- 2.1 Fysiskt utseende
- 2.2 Lukt och smak
- 2.3 Molmassa
- 2.4 Densitet
- 2.5 Ångdensitet
- 2.6 Ångtryck
- 2.7 Kokpunkt
- 2.8 Smältpunkt
- 2.9 Flampunkt
- 2.10 Självantändningstemperatur
- 2.11 Löslighet
- 2.12 Viskositet
- 2.13 Ytspänning
- 2.14 Brytningsindex
- 2.15 Värmekapacitet
- 3 användningsområden
- 3.1 Råvara
- 3.2 Dofter
- 3.3 Skumdämpare
- 3.4 Extraktioner
- 4 risker
- 4.1 Lagring och reaktivitet
- 4.2 Hälsa
- 5 Referenser
Struktur av isoamylalkohol
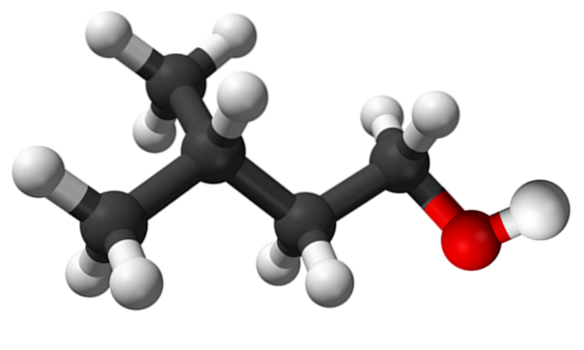
Den övre bilden visar isoamylalkoholmolekylen representerad med en sfär- och stapelmodell. Till höger om den motsvarar den rödaktiga sfären OH-gruppens syreatom, karakteristisk för alla alkoholer; medan till vänster är kolskelettet med en metylgrupp, CH3, förgreningsstruktur.
Ur molekylär synvinkel är denna förening dynamisk eftersom den har atomer med sp-hybridiseringar3, underlätta rotation av dina länkar; så länge det inte får OH och CH att förmörkas3.
Det är också värt att nämna dess amfifila egenskaper: den har en apolär eller hydrofob ände, som består av kedjan (CH3)tvåCHCHtvåCHtvå-, och ett polärt eller hydrofilt huvud, OH-gruppen. Denna definition av två specifika områden med olika polaritet gör denna alkohol till ett ytaktivt medel; och följaktligen dess tillämpning för mikroemulsioner.
Intermolekylära interaktioner
Med tanke på närvaron av OH-gruppen uppvisar isoamylalkoholmolekylen ett permanent dipolmoment. Följaktligen lyckas dipol-dipolkrafterna att binda sina molekyler, ansvariga för vätskans fysiska och mätbara egenskaper, liksom dess lukt..
Även om förgreningen av huvudkedjorna minskar de effektiva interaktionerna mellan molekylerna kompenserar vätebindningarna i denna alkohol för denna minskning, vilket får vätskan att koka vid 131 ° C, en temperatur över kokpunkten för vatten..
Inte detsamma händer med dess fasta eller "is", som smälter vid -117 ° C, vilket indikerar att dess intermolekylära interaktioner inte är tillräckligt starka för att hålla sina molekyler i ordning; särskilt om CH-gruppen3 som grenar huvudkedjan förhindrar bättre kontakt mellan molekylerna.
Egenskaper
Fysiskt utseende
Färglös vätska.
Lukt och smak
Ger en obehaglig päronliknande lukt och har en skarp smak.
Molmassa
88,148 g / mol.
Densitet
0,8104 g / ml vid 20 ° C Det är därför mindre tätt än vatten.
Ång-densitet
Det är 3,04 gånger tätare än luft.
Ångtryck
2,37 mmHg vid 25 ° C.
Kokpunkt
131,1 ° C.
Smältpunkt
-117,2 ° C.
antändningspunkt
43 ° C (sluten kopp).
Självantändningstemperatur
340 ° C.
Löslighet
Det är relativt lösligt i vatten: 28 g / L. Detta beror på att de mycket polära molekylerna i vatten inte har någon speciell affinitet för kolkedjan av isoamylalkohol. Om de blandades skulle två faser observeras: en lägre, motsvarande vatten och en högre, den för isoamylalkohol..
Däremot är det mycket mer lösligt i mindre polära lösningsmedel såsom: aceton, dietyleter, kloroform, etanol eller isättika; och även i petroleumeter.
Viskositet
3 738 cP vid 25 ° C.
Ytspänning
24,77 dyn / cm vid 15 ° C.
Brytningsindex
1,4075 vid 20 ° C.
Värmekapacitet
2.382 kJ / gK.
Applikationer
Råmaterial
Andra estrar, tiofen och läkemedel såsom amylnitrit, Validol (mentylisovalerat), Bromisoval (bromovalerylurea), Corvalol (en valerian lugnande medel) och Barbamil (amobarbital) kan syntetiseras från isoamylalkohol..
Dofter
Förutom att de används för syntes av amylacetat, som har en bananarom, erhålls också andra fruktdoftar som aprikos, apelsiner, plommon, körsbär och malt. Därför är det en nödvändig alkohol vid produktion av många ätbara eller kosmetiska produkter..
Skumdämpare
Genom att minska ytspänningen främjar det dess användning i mikroemulgerade system. I praktiken undviker den accelererade bildandet av bubblor och minskar dem i storlek tills de går sönder.
Det hjälper också till att bättre definiera gränssnittet mellan de vattenhaltiga och organiska faserna under extraktion; till exempel tillsätts fenol-kloroform till extraktionsblandningen i ett förhållande av 25: 24: 1. Denna teknik är avsedd för DNA-extraktion.
Extraktioner
Isoamylalkohol gör det också möjligt att extrahera fetter eller oljor från olika prover, till exempel från mjölk. På samma sätt löser det upp paraffinvax, bläck, tandkött, lack och cellulosaestrar.
Fortsatt med extraktionerna är det möjligt att erhålla fosforsyra från nitratlösningar av järnfosfatmineraler..
Risker
Lagring och reaktivitet
Liksom alla vätskor som avger lukt kan det utgöra en överhängande brandrisk om platsen där den förvaras höjer temperaturen för högt, ännu mer om det redan finns en värmekälla.
Under dessa förhållanden fungerar det helt enkelt som ett bränsle, tankar lågorna och till och med exploderar dess behållare. Vid bränning släpper det ut ångor som kan påverka hälsan och orsaka kvävning.
Andra orsaker till att isoamylalkohol tar eld är att blanda den eller få den att reagera med ämnen som: perklorater, peroxider, brom, fluor, metallhydrider, starka syror, alifatiska aminer etc..
Hälsa
Vid hudkontakt kan det irritera och torka ut det. Symtomen är dock allvarligare vid inandning för länge (hosta, brännskador på näsa, hals och lungor) eller vid förtäring (huvudvärk, illamående, diarré, kräkningar, yrsel och medvetslöshet).
Och slutligen, när det läcker ut i ögonen, irriterar det dem och kan till och med oåterkalleligt skada dem. Lyckligtvis tillåter dess "alkoholhaltiga päron" -lukt det att upptäckas i händelse av läckage eller spill. utöver detta är det en förening som måste hanteras med respekt.
Referenser
- Morrison, R. T. och Boyd, R, N. (1987). Organisk kemi. 5: e upplagan. Ledare Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley plus.
- Wikipedia. (2019). Isoamylalkohol. Återställd från: en.wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Isoamylalkohol. PubChem-databas. CID = 31260. Återställd från: pubchem.ncbi.nlm.nih.gov
- Zhang Yu & Muhammed Mamoun. (17 september 2008). Extraktion av fosforsyra från nitratlösningar med isoamylalkohol. Solvent Extraction and Ion Exchange Volume 6, 1988 - Issue 6. doi.org/10.1080/07366298808917973
- New Jersey Department of Health. (2008). Isoamylalkohol. [PDF]. Återställd från: nj.gov
- Kat Chem. (2019). Isoamylalkohol. Återställd från: kat-chem.hu
- Chemoxy International Ltd. (s.f.). Isoamylalkohol. Återställd från: chemoxy.com



Ingen har kommenterat den här artikeln än.