
Endergonic reaktionsegenskaper, exempel
A endergonisk reaktion Det är en som inte kan hända spontant, och som också kräver en hög energitillförsel. I kemi är denna energi i allmänhet kalorisk. Den mest kända av alla endergoniska reaktioner är endoterma reaktioner, det vill säga de som absorberar värme för att uppstå.
Varför är inte alla reaktioner spontana? Eftersom de går uppåt till termodynamikens lagar: de förbrukar energi och de system som bildas av de inblandade arterna minskar deras entropi; för kemiska ändamål blir de mer molekylärt ordnade.

Att bygga en tegelvägg är ett exempel på en endergonisk reaktion. Tegelstenar komprimerar inte tillräckligt för att bilda en solid kropp. Detta beror på att det inte finns någon energivinst som främjar deras fackföreningar (återspeglas också i deras möjliga låga intermolekylära interaktioner).
Så för att bygga väggen behöver du cement och en arbetskraft. Detta är energi, och den icke-spontana reaktionen (väggen byggs inte automatiskt) blir möjlig om en energifördel uppfattas (ekonomisk, i fallet med väggen).
Om det inte finns någon fördel, kommer väggen att kollapsa under störningar, och dess tegel kommer aldrig att kunna hålla ihop. Detsamma gäller många kemiska föreningar, vars byggstenar inte spontant kan komma ihop..
Artikelindex
- 1 Egenskaper för en endergonisk reaktion
- 1.1 Ökar systemets fria energi
- 1.2 Dina produktlänkar är svagare
- 1.3 Det är kopplat till exergoniska reaktioner
- 2 Exempel
- 2.1 Fotosyntes
- 2.2 Syntes av biomolekyler och makromolekyler
- 2.3 Bildandet av diamanter och tunga föreningar från råolja
- 3 Referenser
Kännetecken för en endergonisk reaktion
Vad händer om väggen kan byggas spontant? För detta måste interaktionerna mellan tegelstenarna vara mycket starka och stabila, så mycket att inget cement eller någon person behöver beställa dem; medan tegelväggen, även om den är motståndskraftig, är det härdade cementet som håller dem ihop och inte korrekt tegelstenens material.
Därför är de första egenskaperna hos en endergonisk reaktion:
-Det är inte spontant
-Absorberar värme (eller annan energi)
Och varför absorberar den energi? Eftersom dess produkter har mer energi än de reaktanter som är inblandade i reaktionen. Detta kan representeras av följande ekvation:
AG = GProdukter-GReagenser
Där ΔG är förändringen i Gibbs fri energi. Som GProdukt är större (eftersom den är mer energisk) än GReagenser, subtraheringen måste vara större än noll (ΔG> 0). Följande bild sammanfattar ytterligare vad som just har förklarats:
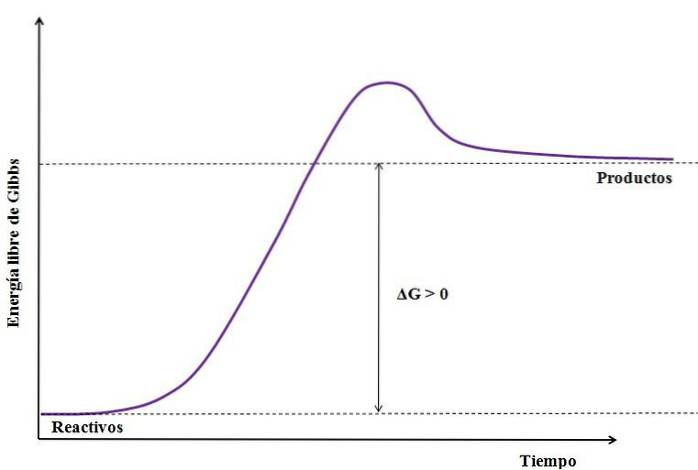
Notera skillnaden mellan energitillstånden mellan produkterna och reaktanterna (lila linje). Därför blir reaktanter inte produkter (A + B => C) om det inte finns någon värmeupptagning först..
Ökar systemets fria energi
Varje endergonic reaktion är förknippad med en ökning av Gibbs fria energi i systemet. Om det för en viss reaktion är nöjd med att ΔG> 0, kommer det inte att vara spontant och kommer att kräva en energiförsörjning.
Hur vet man matematiskt om en reaktion är endergonisk eller inte? Tillämpar följande ekvation:
AG = AH-TAS
Där ΔH är reaktionens entalpi, det vill säga den totala energin som frigörs eller absorberas; ΔS är entropiändringen och T är temperaturen. TΔS-faktorn är förlusten av energi som inte används vid expansion eller arrangemang av molekylerna i en fas (fast, flytande eller gas).
Således är ΔG den energi som systemet kan använda för att utföra arbete. Eftersom ΔG har ett positivt tecken för en endergonisk reaktion måste energi eller arbete appliceras på systemet (reaktanterna) för att erhålla produkterna.
Sedan, med kännedom om värdena för AH (positiv, för en endoterm reaktion och negativ, för en exoterm reaktion) och TΔS, är det möjligt att veta om reaktionen är endergonisk. Detta innebär att även om en reaktion är endoterm, inte det är nödvändigtvis endergonic.
Isbitar
Till exempel smälter en isbit till flytande vatten och absorberar värme, vilket hjälper till att separera dess molekyler. processen är emellertid spontan och därför är den inte en endergonisk reaktion.
Och hur är det med situationen där du vill smälta isen vid en temperatur långt under -100ºC? I detta fall blir TΔS-termen i den fria energiekvationen liten jämfört med ΔH (eftersom T minskar), och som ett resultat kommer ΔG att ha ett positivt värde.
Med andra ord: att smälta is under -100ºC är en endergonisk process, och det är inte spontant. Ett liknande fall är att frysa vattnet runt 50 ° C, vilket inte händer spontant..
Dina produktlänkar är svagare
En annan viktig egenskap, även relaterad till ΔG, är energin hos de nya bindningarna. Bindningarna för de bildade produkterna är svagare än för reaktanterna. Emellertid kompenseras minskningen av bindarnas styrka av en massaökning, vilket återspeglas i de fysiska egenskaperna.
Här börjar jämförelsen med tegelväggen tappa mening. Enligt ovanstående måste bindningarna i tegelstenarna vara starkare än de mellan dem och cementen. Väggen som helhet är dock mer stel och motståndskraftig på grund av dess större massa..
Något liknande kommer att förklaras i avsnittet exempel, men med socker.
Det är kopplat till exergoniska reaktioner
Om endergoniska reaktioner inte är spontana, hur sker de i naturen? Svaret beror på kopplingen till andra reaktioner som är ganska spontana (exergoniska) och som på något sätt främjar deras utveckling..
Till exempel representerar följande kemiska ekvation denna punkt:
A + B => C (endergonisk reaktion)
C + D => E (exergonisk reaktion)
Den första reaktionen är inte spontan, så den kunde naturligtvis inte inträffa. Produktionen av C tillåter dock att den andra reaktionen inträffar och orsakar E..
Lägga till Gibbs fria energier för de två reaktionerna, ΔG1 och AGtvå, med ett resultat mindre än noll (ΔG<0), entonces el sistema presentará un incremento de la entropía y por lo tanto será espontáneo.
Om C inte reagerade med D kunde A aldrig bilda det, eftersom det inte finns någon energikompensation (som i fallet med pengar med tegelväggen). Det sägs sedan att C och D "drar" A och B för att reagera, även om det är en endergonisk reaktion..
Exempel

Fotosyntes
Växter använder solenergi för att skapa kolhydrater och syre från koldioxid och vatten. Kompaniettvå migtvå, små molekyler med starka bindningar, bildar sockerarter, med ringstrukturer, som är tyngre, mer fasta och smälter vid en temperatur av cirka 186 ºC..
Observera att C-C-, C-H- och C-O-bindningarna är svagare än de för O = C = O och O = O. Och från en sockerenhet kan växten syntetisera polysackarider, såsom cellulosa.
Syntes av biomolekyler och makromolekyler
Endergonic reaktioner är en del av anabola processer. Liksom kolhydrater kräver andra biomolekyler, såsom proteiner och lipider, komplexa mekanismer som utan dem och koppling till ATP: s hydrolysreaktion inte kunde existera.
På samma sätt är metaboliska processer såsom cellulär andning, diffusion av joner genom cellmembran och transport av syre genom blodomloppet exempel på endergoniska reaktioner..
Bildandet av diamanter och tunga föreningar från råolja
Diamanter kräver enorma tryck och temperaturer, så att deras komponenter kan komprimeras till ett kristallint fast ämne..
Vissa kristallisationer är emellertid spontana, även om de förekommer i mycket låga hastigheter (spontanitet har ingen relation till reaktionens kinetik).
Slutligen representerar råolja en produkt av endergoniska reaktioner, särskilt tunga kolväten eller makromolekyler som kallas asfaltener..
Deras strukturer är mycket komplexa, och deras syntes tar lång tid (miljoner år), värme och bakterieverkan..
Referenser
- QuimiTube. (2014). Endergoniska och exergoniska reaktioner. Återställd från: quimitube.com
- Khan akademin. (2018). Fri energi. Återställd från: es.khanacademy.org
- Biology Dictionary. (2017). Definition av endergonisk reaktion. Återställd från: biologydictionary.net
- Lougee, Mary. (18 maj 2018). Vad är en endergonisk reaktion? Sciencing. Återställd från: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (22 juni 2018). Endergonic vs Exergonic (med exempel). Återställd från: thoughtco.com
- Arrington D. (2018). Endergonic reaktion: definition & exempel. Studie. Återställd från: study.com
- Audersirk Byers. (2009). Livet på jorden. Vad är energi? [PDF]. Återställd från: hhh.gavilan.edu


Ingen har kommenterat den här artikeln än.