
Aminstruktur, egenskaper, typer, användningsområden, exempel
De aminer de är organiska föreningar härledda från ammoniak. I dem finns kovalenta bindningar mellan kol och kväve. Naturligtvis är kvävemolekylen kinetiskt inert; men tack vare den biologiska fixeringen omvandlas den till ammoniak, som i sin tur genomgår efterföljande alkyleringsreaktioner.
När ammoniak är "alkylerad" ersätter den en, två eller tre av dess tre väten med kolatomer. Dessa kol kan mycket väl komma från en alkyl (R) eller aryl (Ar) grupp. Således finns det alifatiska aminer (linjära eller grenade) och aromatiska.

Den allmänna formeln för alifatiska aminer visas ovan. Denna formel kan användas för aromatiska aminer, med tanke på att R också kan vara en arylgrupp Ar. Notera likheten mellan amin och ammoniak, NH3. I praktiken har en H ersatts av en R-sidokedja.
Om R består av alifatiska kedjor, har du det som kallas en alkylamin; medan om R är aromatisk till sin natur, en arylamin. Av arylaminerna är det viktigaste av allt alanin: en aminogrupp, -NHtvå, bunden till bensenringen.
När det finns syresatta grupper i en molekylär struktur, såsom OH och COOH, kallas föreningen inte längre en amin. I det fallet anses aminen vara en substituent: aminogruppen. Till exempel inträffar detta i aminosyror, liksom i andra biomolekyler av enorm betydelse för livet..
Eftersom kväve finns i många av de väsentliga föreningarna för livet, ansågs de vara vitala aminer; dvs. "vitaminer". Men många av vitaminerna är inte ens aminer, och dessutom är inte alla avgörande för livet. Detta upphäver dock inte dess stora betydelse i levande organismer..
Aminer är starkare organiska baser än ammoniak i sig. De kan lätt extraheras från växtmaterial och har generellt starka interaktioner med organismernas neuronmatris; därför består många läkemedel och läkemedel av aminer med komplexa strukturer och substituenter.
Artikelindex
- 1 Struktur
- 2 Egenskaper hos aminer
- 2.1 Polaritet
- 2.2 Fysiska egenskaper
- 2.3 Löslighet i vatten
- 2.4 Grundläggande
- 3 typer (primär, sekundär, tertiär)
- 4 Träning
- 4.1 Alkylering av ammoniak
- 4.2 Katalytisk hydrering
- 5 Nomenklatur
- 6 användningsområden
- 6.1 Färgämnen
- 6.2 Läkemedel och droger
- 6.3 Gasbehandling
- 6.4 Jordbrukskemi
- 6.5 Tillverkning av hartser
- 6.6 Djurens näringsämnen
- 6.7 Gummiindustrin
- 6.8 Lösningsmedel
- 7 Exempel
- 7.1 Kokain
- 7.2 Nikotin
- 7.3 Morfin
- 7.4 Serotonin
- 8 Referenser
Strukturera
Vad är dess struktur? Även om det varierar beroende på naturen hos R är kväveatomens elektroniska miljö densamma för dem alla: tetraedral. Men eftersom det finns ett par odelade elektroner på kväveatomen (··) blir molekylgeometrin pyramidal. Detta är så med ammoniak och aminer.
Aminer kan representeras av en tetraeder, precis som kolföreningar. Således NH3 och CH4 ritas som tetraeder, där paret (··) är beläget vid en av topparna ovanför kvävet.
Båda molekylerna är achirala; emellertid börjar de presentera kiralitet då deras H ersätts med R. Aminen RtvåNH är achiral om de två R är olika. Det saknar dock någon konfiguration för att skilja en enantiomer från en annan (som är fallet med kirala kolcentra).
Detta beror på att enantiomererna:
RtvåN-H | H-NRtvå
de byts ut i en sådan takt att ingen av dem kan isolera sig; och därför anses strukturerna av aminer vara achirala även om alla substituenterna på kväveatomen är olika.
Egenskaper hos aminer
Polaritet
Aminer är polära föreningar, eftersom aminogruppen NHtvå, genom att ha en elektronegativ kväveatom bidrar det till molekylets dipolmoment. Observera att kväve har förmågan att donera vätebindningar, vilket gör att aminer i allmänhet har höga kokpunkter och smältpunkter..
Men när denna egenskap jämförs med den hos syresatta föreningar, såsom alkoholer och karboxylsyror, resulterar de i lägre magnituder..
Till exempel kokpunkten för etylamin, CH3CHtvåNHtvå (16,6 ° C) är lägre än för etanol, CH3CHtvåOH (78ºC).
Således visas det att O-H-vätebindningar är starkare än N-H, även om en amin kan bilda mer än en brygga. Denna jämförelse gäller endast om R har samma molekylvikt för de två föreningarna (CH3CHtvå-). Å andra sidan kokar etan vid --89 ° C, CH3CH3, vara en gas vid rumstemperatur.
Eftersom en amin har mindre väte bildar den färre vätebindningar och dess kokpunkt sänks. Detta ses genom att jämföra kokpunkten för dimetylamin, (CH3)tvåNH (7 ° C), med etylamin (16,6 ° C).
Fysiska egenskaper
I kemins värld, när du pratar om en amin, uppstår den ofrivilliga handlingen att hålla näsan. Detta beror på att de i allmänhet tenderar att ha obehagliga lukt, varav några liknar den hos ruttna fiskar..
Dessutom tenderar flytande aminer att ha gulaktiga toner, vilket ökar den visuella misstro de genererar..
Vattenlöslighet
Aminer tenderar att vara olösliga i vatten eftersom, trots att de kan bilda vätebindningar med HtvåEller dess huvudsakliga organiska komponent är hydrofob. Ju större eller längre R-grupperna är, desto lägre är deras löslighet i vatten..
När det finns en syra i mediet ökas emellertid lösligheten genom bildandet av så kallade aminsalter. I dem har kväve en positiv partiell laddning som elektrostatiskt drar till sig anjon- eller konjugatbasen i syran..
Till exempel i en utspädd lösning av HCl, aminen RNHtvå reagerar enligt följande:
RNHtvå + HCl => RNH3+Cl- (primärt salt av amin)
RNHtvå Det var olösligt (eller lätt lösligt) i vatten, och i närvaro av syran bildar det ett salt vars lösning av dess joner gynnar dess löslighet.
Varför händer detta? Svaret ligger i en av huvudegenskaperna hos aminer: de är polära och grundläggande. Eftersom de är basiska kommer de att reagera med syror som är tillräckligt starka för att protonera dem, enligt Brönsted-Lowry-definitionen..
Grundläggande
Aminer är starkare organiska baser än ammoniak. Ju högre elektrondensitet runt kväveatomen, desto mer grundläggande blir den; det vill säga det kommer att deprotonera syrorna i miljön snabbare. Om aminen är väldigt basisk kan den till och med stjäla protonen från alkoholer.
R-grupperna bidrar med elektrontäthet till kväve genom induktiv effekt; eftersom vi inte får glömma att det är en av de mest elektronegativa atomerna som finns. Om dessa grupper är mycket långa eller skrymmande kommer den induktiva effekten att bli större, vilket också ökar det negativa området runt elektronparet (··).
Detta gör att (··) accepterar H-ionen snabbare+. Men om R är mycket skrymmande minskar grundläggande på grund av den steriska effekten. Varför? Av den enkla anledningen att H+ måste korsa en atomkonfiguration innan de når kväve.
Ett annat sätt att resonera om basen hos en amin är att stabilisera dess aminsalt. Nu kan den som minskar med induktiv effekt minska den positiva laddningen N+, det blir en mer grundläggande amin. Anledningarna är desamma just förklarade.
Alkylaminer mot arylaminer
Alkylaminer är mycket mer grundläggande än arylaminer. Varför? För att förstå det enkelt visas strukturen för anilin:
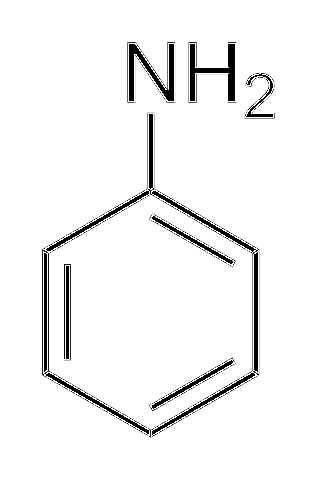
Ovan, i aminogruppen, är elektronparet (··). Detta par "färdas" inuti ringen i orto- och parapositioner med avseende på NHtvå. Det betyder att de två övre topparna och motsatsen till NHtvå är negativt laddade, medan kväveatomen är positivt.
Eftersom kvävet är positivt laddat, +N, stöter bort H-jonen+. Och om detta inte räcker, avlägsnas elektronparet i den aromatiska ringen, vilket gör det mindre tillgängligt för deprotonatsyror..
Anilinens basicitet kan öka om grupper eller atomer som ger den elektroniska densiteten är kopplade till ringen, konkurrerar med paret (··) och tvingar den att placeras med större sannolikhet på kväveatomen, redo att fungera som en bas.
Typer (primär, sekundär, tertiär)

Även om det inte formellt presenteras har hänvisning implicit gjorts till primära, sekundära och tertiära aminer (översta bilden, vänster till höger).
Primära aminer (RNHtvåär de monosubstituerade; de sekundära (RtvåNH), är disubstituerade, med två R-alkyl- eller arylgrupper; och de tertiära (R3N), är trisubstituerade och saknar väte.
Alla befintliga aminer härrör från dessa tre typer, så deras mångfald och interaktioner med den biologiska och neuronala matrisen är enorma.
I allmänhet kan tertiära aminer förväntas vara de mest basiska; Ett sådant uttalande kan dock inte göras utan att känna strukturerna för R.
Träning
Ammoniakalkylering
Först nämndes att aminer härrör från ammoniak; därför är det enklaste sättet att bilda dem genom att alkylera dem. För att göra detta reageras ett överskott av ammoniak med en alkylhalogenid följt av tillsatsen av en bas för att neutralisera aminsaltet:
NH3 + RX => RNH3+X- => RNHtvå
Observera att dessa steg leder till en primär amin. Sekundära och till och med tertiära aminer kan också bildas, så utbytet för en enda produkt minskar.
Vissa träningsmetoder, såsom Gabrielsyntesen, gör det möjligt att erhålla primära aminer så att andra oönskade produkter inte bildas.
Dessutom kan ketoner och aldehyder reduceras i närvaro av ammoniak och primära aminer för att ge upphov till sekundära och tertiära aminer..
Katalytisk hydrering
Nitroföreningar kan reduceras i närvaro av väte och en katalysator till deras motsvarande aminer.
ArNOtvå => ArNHtvå
Nitriler, RC≡N och amider, RCONRtvå, reduceras också för att ge primära respektive tertiära aminer.
Nomenklatur
Hur heter aminer? För det mesta namnges de baserat på R, alkyl- eller arylgruppen. Till namnet på R, härledt från dess alkan, läggs ordet "amin" till i slutet.
Således CH3CHtvåCHtvåNHtvå är propylamin. Å andra sidan kan den namnges endast med tanke på alkanen och inte som en R-grupp: propanamin.
Det första sättet att namnge dem är överlägset det mest kända och mest använda.
När det finns två NH-gruppertvå, alkanen heter och positionerna för aminogrupperna listas. Således har HtvåNCHtvåCHtvåCHtvåCHtvåNHtvå kallas: 1,4-butandiamin.
Om det finns syresatta grupper, såsom OH, bör det prioriteras framför NHtvå, som råkar kallas som en substituent. Till exempel HOCHtvåCHtvåCHtvåNHtvå Det kallas: 3-aminopropanol.
Och med avseende på sekundära och tertiära aminer används bokstäverna N för att indikera R-grupperna. Den längsta kedjan kommer att förbli med namnet på föreningen. Således kan ch3NHCHtvåCH3 Det kallas: N-metyletylamin.
Applikationer
Färgämnen
Primära aromatiska aminer kan fungera som utgångsmaterial för azofärgningssyntes. Inledningsvis reagerar aminer för att bilda diazoniumsalter, som bildar azoföreningar genom azokoppling (eller diazokoppling)..
Dessa, på grund av sin intensiva färgning, används i textilindustrin som färgämne; till exempel: metylorange, direktbrun 138, solnedgångsgul FCF och ponceau.
Droger och droger
Många läkemedel fungerar med agonister och antagonister av naturliga neurotransmittorer. Exempel:
-Klorfeniramin är en antihistamin som används vid kontroll av allergiska processer på grund av intag av vissa livsmedel, hösnuva, insektsbett etc..
-Klorpromazin är ett lugnande medel, inte ett sömnframkallande medel. Lindrar ångest och används till och med vid behandling av vissa psykiska störningar.
-Efedrin och fenylefedrin används som luftvägsavsvällande medel.
-Amitriptylin och imipramin är tertiära aminer som används vid behandling av depression. På grund av sin struktur klassificeras de som tricykliska antidepressiva medel..
-Opioida smärtstillande medel som morfin, kodlinje och heroin är tertiära aminer.
Gasbehandling
Flera aminer, inklusive diglykolamin (DGA) och dietanolamin (DEA), används vid eliminering av koldioxid (COtvåvätesulfid (HtvåS) närvarande i naturgas och raffinaderier.
Jordbrukskemi
Metylaminer är intermediära föreningar vid syntes av kemikalier som används inom jordbruket som herbicider, fungicider, insekticider och biocider..
Harts tillverkning
Metylaminer används under produktionen av jonbytarhartser, användbara vid avjonisering av vatten.
Djurens näringsämnen
Trimetylamin (TMA) används främst vid produktion av kolinklorid, ett vitamin B-tillskott som används i foder av kycklingar, kalkoner och grisar..
Gummiindustrin
Dimetylaminoleat (DMA) är ett emulgeringsmedel för användning vid tillverkning av syntetiskt gummi. DMA används direkt som en polymerisationsmodifierare i ångfasen av butadien och som en stabilisator för naturgummilatex i stället för ammoniak
Lösningsmedel
Dimetylamin (DMA) och monometylamin (MMA) används för att syntetisera de aprotiska polära lösningsmedlen dimetylformamid (DMF), dimetylacetamid (DMAc) och n-metylpyrrolidon (NMP).
Tillämpningar för DMF inkluderar: uretanbeläggning, akrylgarnlösningsmedel, reaktionslösningsmedel och extraktionslösningsmedel.
DMAc används vid tillverkning av garnfärgämnen och lösningsmedel. Slutligen används NMP vid raffinering av smörjoljor, färgavdragare och emaljbeläggning..
Exempel
Kokain
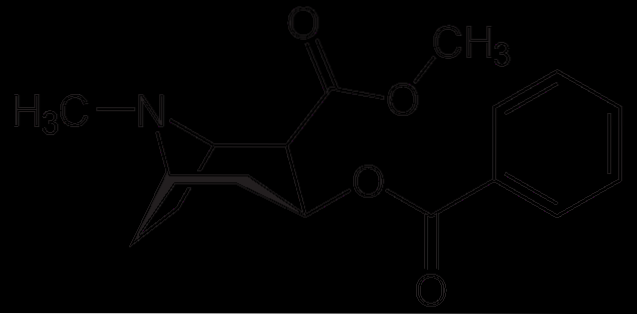
Kokain används som lokalbedövning vid vissa typer av ögon-, öron- och halsoperationer. Som det ses är det en tertiär amin.
Nikotin

Nikotin är det primära medlet för tobaksberoende och kemiskt är det en tertiär amin. Nikotinet i tobaksrök absorberas snabbt och är mycket giftigt.
Morfin
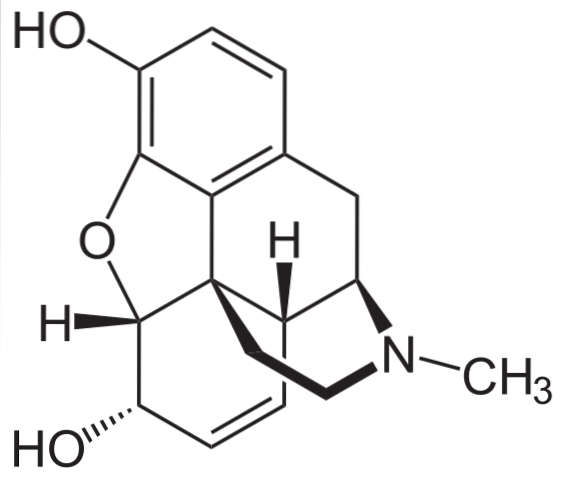
Det är en av de mest effektiva smärtstillande medlen för att lindra smärta, särskilt cancer. Det är återigen en tertiär amin.
Serotonin

Serotonin är en amin-neurotransmittor. Hos deprimerade patienter minskar koncentrationen av huvudmetaboliten i serotonin. Till skillnad från de andra aminerna är den här primär.
Referenser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10th utgåva.). Wiley plus.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Morrison och Boyd. (1987). Organisk kemi. (Femte upplagan). Addison-Wesley Iberoamericana.
- The Chemours Company. (2018). Metylaminer: användningsområden och applikationer. Återställd från: chemours.com
- Transparency Market Research. (s.f.). Aminer: viktiga fakta och användningsområden. Återställd från: transparencymarketresearch.com
- Wikipedia. (2019). Amine. Återställd från: en.wikipedia.org
- Ganong, W. F. (2003). Medicinsk fysiologi. 19: e upplagan. Ledare The Modern Manual.



Ingen har kommenterat den här artikeln än.