
Vätebromid (HBr) Egenskaper, syntes och användningar

De vätebromid, en kemisk förening med formeln HBr, den är en diatomisk molekyl med en kovalent bindning. Föreningen klassificeras som en vätehalogenid, eftersom den är en färglös gas som, när den löses i vatten, bildar bromvätesyra och mättar sig vid 68,85 viktprocent vid rumstemperatur..
Vattenlösningar vid 47,6% vikt / vikt bildar en konstant kokande azeotrop blandning som kokar vid 124,3 ° C. Mindre koncentrerade, kokande lösningar frigör H2O tills sammansättningen av den konstantkokande azeotropa blandningen har uppnåtts..
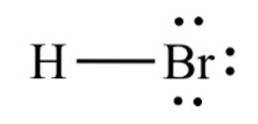
Artikelindex
- 1 Fysikaliska och kemiska egenskaper
- 2 Reaktivitet och faror
- 3 Hantering och lagring
- 4 Syntes
- 5 användningsområden
- 6 Referenser
Fysiska och kemiska egenskaper
Vätebromid är en färglös gas vid rumstemperatur med en sur, irriterande lukt. Föreningen är stabil men mörknar gradvis när den utsätts för luft eller ljus som illustreras i figur 2 (National Center for Biotechnology Information, S.F.).

Den har en molekylvikt på 80,91 g / mol och en densitet på 3,307 g / L, vilket gör den tyngre än luft. Gasen kondenserar och producerar en färglös vätska med en kokpunkt på -66,73 grader Celsius.
När den fortsätter att svalna stelnar vätskan och erhåller vita kristaller, vars smältpunkt är -86,82 ° C med en densitet av 2,603 g / ml (Egon Wiberg, 2001). Utseendet på dessa kristaller illustreras i figur 3.

Bindningsavståndet mellan brom och väte är 1,414 ångström och deras dissocieringsenergi är 362,5 kJ / mol..
Vätebromid är mer lösligt i vatten än väteklorid, 221 g kan lösas i 100 ml vatten vid 0 grader Celsius, vilket motsvarar en volym på 612 liter av denna gas för varje liter vatten. Det är också lösligt i alkohol och andra organiska lösningsmedel.
I vattenhaltig lösning (bromvätesyra) är de sura egenskaperna hos HBr dominerande (som är fallet med HF och HCl) och i bindningen mellan väte och halogen är den svagare när det gäller vätebromid än i väteklorid.
Om klor passeras genom vätebromiden observeras därför bildningen av bruna ångor som är karakteristiska för molekylär brom. Reaktionen som förklarar det är följande:
2HBr + Cl2 → 2HCl + Br2
Detta är ett tecken på att vätebromid är ett starkare reduktionsmedel än väteklorid och att väteklorid är ett bättre oxidationsmedel..
Vätebromid är en vattenfri stark syra (utan vatten). Reagerar snabbt och exotermiskt med baser av alla slag (inklusive aminer och amider).
Reagerar exotermiskt med karbonater (inklusive kalksten och kalkstenhaltiga byggmaterial) och vätekarbonat för att generera koldioxid.
Reagerar med sulfider, karbider, borider och fosfider för att generera giftiga eller brandfarliga gaser.
Reagerar med många metaller (inklusive aluminium, zink, kalcium, magnesium, järn, tenn och alla alkalimetaller) för att generera brandfarlig vätgas.
Svara våldsamt med:
- ättiksyraanhydrid
- 2-aminoetanol
- ammoniumhydroxid
- kalciumfosfid
- klorsulfonsyra
- 1,1-difluoroeten
- etylendiamin
- etylenimin
- rökande svavelsyra
- Perklorsyra
- b-propriolakton
- propylens OXID
- silverperklorat
- Uran (IV) fosfid
- vinylacetat
- kalciumkarbid
- rubidiumkarbid
- cesiumacetylid
- rubidiumacetylid
- magnesiumborid
- kvicksilver (II) sulfat
- kalciumfosfid
- kalciumkarbid (kemiskt datablad, 2016).
Reaktivitet och faror
Vätebromid klassificeras som en frätande och irriterande förening. Det är extremt farligt vid hudkontakt (irriterande och frätande) och ögonen (irriterande) och i fall av förtäring och inandning (lungirriterande).
Föreningen lagras i tryckbehållare med flytande gas. Långvarig exponering för eld eller intensiv värme kan resultera i en våldsam bristning av tryckbehållaren, som kan frigöras och frigöra irriterande giftiga ångor..
Långvarig exponering för låga koncentrationer eller kortvarig exponering för höga koncentrationer kan leda till negativa hälsoeffekter på grund av inandning..
Termisk nedbrytning av vattenfri vätebromid ger giftiga bromgaser. Det kan bli brandfarligt om det reagerar genom att släppa ut väte. Kontakt med cyanid producerar giftiga vätecyanidgaser.
Inandning orsakar allvarlig irritation i näsan och övre luftvägarna, vilket kan orsaka lungskada..
Förtäring orsakar brännskador i munnen och magen. Kontakt med ögonen orsakar allvarlig irritation och brännskador. Kontakt med huden orsakar irritation och brännskador.
Om denna kemikalie i lösning kommer i kontakt med ögonen, ska de spolas omedelbart med stora mängder vatten och ibland lyfta nedre och övre ögonlocken..
Kontaktlinser bör inte användas när du arbetar med denna kemikalie. Om ögonvävnaden är frusen, sök omedelbart läkare..
Om vävnaden inte är frusen, skölj omedelbart och noggrant ögonen med stora mängder vatten i minst 15 minuter och lyft ibland de nedre och övre ögonlocken..
Om irritation, smärta, svullnad eller sönderrivning kvarstår, kontakta läkare så snart som möjligt..
Om denna kemikalie i lösning kommer i kontakt med huden och inte orsakar frostskada, skölj genast förorenad hud med vatten.
Om denna kemikalie kommer på kläder, ta omedelbart bort kläder och tvätta huden med vatten.
Om frostskador uppstår, kontakta omedelbart läkare. Du bör inte gnugga de drabbade områdena eller skölja med vatten. För att förhindra ytterligare skador på tygerna bör inget försök göras för att ta bort frysta kläder från frostiga områden..
Om stora mängder av denna kemikalie inhaleras, ska den exponerade personen omedelbart flyttas till frisk luft. Om andningen har slutat, utför återupplivning från mun till mun. Offret bör hållas varmt och i vila, och läkare bör sökas så snart som möjligt..
Om denna kemikalie i lösning har sväljts, kontakta läkare omedelbart.
Hantering och lagring
Vätebromidcylindrar ska förvaras på en sval, väl ventilerad plats. Hanteringen måste ske med tillräcklig ventilation. Den bör endast förvaras när temperaturen inte överstiger 52 grader Celsius.
Behållare ska säkras ordentligt i upprätt läge för att förhindra att de faller eller slås. Installera också ventilskyddslocket, om det finns, ordentligt på plats för hand, samt förvara fulla och tomma behållare separat (praxair inc., 2016).
När du hanterar produkten under tryck ska korrekt utformad VVS och utrustning användas för att motstå det tryck som påträffas. Arbeta aldrig på ett trycksatt system och använd en flödesförebyggande anordning i rörledningen. Gaser kan orsaka snabb kvävning på grund av syrebrist.
Förvaring och användning med tillräcklig ventilation är viktigt. Om ett läckage uppstår, stäng behållarventilen och stäng av systemet på ett säkert och miljövänligt sätt. Reparera sedan läckan. Placera aldrig en behållare där den kan ingå i en elektrisk krets.
Läderhandskar och lämpliga skor bör bäras vid hantering av cylindrar. Dessa måste skyddas och för detta ändamål måste de undvikas, släpas, rullas eller glidas..
När cylindern flyttas ska det avtagbara ventilkåpan alltid hållas på plats. Försök aldrig lyfta en cylinder i locket, som endast är avsedd att skydda ventilen..
När du flyttar cylindrar, även för korta sträckor, använd en vagn (vagn, handbil etc.) som är utformad för att transportera cylindrar.
Ett föremål (t.ex. skiftnyckel, skruvmejsel, bändstång) får aldrig föras in i öppningarna i locket, eftersom detta kan skada ventilen och orsaka läckage..
En justerbar remnyckel används för att ta bort lock som är för täta eller rostiga. Ventilen ska öppna långsamt och om detta är omöjligt, sluta använda den och kontakta din leverantör. Naturligtvis måste ventilen på behållaren vara stängd efter varje användning..
Nämnda behållare måste hållas stängd även när den är tom. Flamma eller lokal värme bör aldrig appliceras direkt på någon del av behållaren. Höga temperaturer kan skada behållaren och orsaka att tryckavlastningsanordningen misslyckas i förtid och ventilerar innehållet i behållaren (praxair inc., 2016).
Syntes
Vätebromidgas kan tillverkas i laboratoriet genom bromering av tetralin (1,2,3,4-tetrahydronaftalen). Nackdelen är att hälften av brom går förlorad. Utbytet är ungefär 94%, eller vad som är detsamma, 47% av brom hamnar som HBr.
C10H12 + 4 brtvå → C10H8Br4 + 4 HBr
Vätebromidgas kan också syntetiseras i laboratoriet genom att reagera koncentrerad svavelsyra med natriumbromid..
NaBr (s) + HtvåSW4 → HBr (g) + NaHSO4
Nackdelen med denna metod är att mycket av produkten går förlorad genom oxidation med överskott av svavelsyra för att bilda brom och svaveldioxid..
2 HBr + HtvåSW4 → Brtvå + SWtvå + 2 timmartvåELLER
Vätebromid kan framställas i laboratoriet genom reaktion mellan renad vätgas och brom. Detta katalyseras av platinaasbest och utförs i ett kvartsrör vid 250 ° C.
Brtvå + Htvå[Pt] → 2 HBr
Vattenfri vätebromid kan också framställas i liten skala genom termolys av trifenylfosfoniumbromid i xylen under återflöde..
HBr kan erhållas med den röda fosformetoden. Först tillsättes den röda fosfor i vattenreaktorn och senare långsamt kommer brom under omrörning och reaktion mellan bromvätesyra och fosforsyra, genom sedimentering, filtrering och destillation som erhålls vara bromvätesyra..
P4+6 Brtvå+12 timmartvåO → 12 HBr + 4 H3PO3
Vätebromid framställd enligt ovanstående metoder kan förorenas med Brtvå, som kan avlägsnas genom att leda gasen genom en lösning av fenol i tetraklormetan eller annat lämpligt lösningsmedel vid rumstemperatur, vilket ger 2, 4, 6-tribromfenol och därigenom genererar mer HBr.
Denna process kan också genomföras genom kopparflis med hög temperatur eller koppargas (väte: vätebromid, 1993-2016).
Applikationer
HBr används vid tillverkning av organiska bromider, såsom metylbromid, bromoetan, etc., och oorganiska sådana, såsom natriumbromid, kaliumbromid, litiumbromid och kalciumbromid, etc..
Det används också i fotografiska och farmaceutiska applikationer eller för syntes av lugnande medel och anestetika. Dessutom appliceras den i industriell torkning, textilbehandling, beläggningsmedel, ytbehandling och brandsäkerhetsmedel..
Föreningen används också för att etsa polysilikonark för tillverkning av datachips (Interscan Corporation, 2017).
Vätebromid är ett bra lösningsmedel för vissa metallmalmer, som används vid förfining av metaller med hög renhet.
Inom petroleumsindustrin används den som en separation av alkoxi- och fenoxiföreningar och som en katalysator för oxidation av cykliska kolväten och kedjekolväten till ketoner, syra eller peroxid. Det används också i syntetiska färgämnen och kryddor..
En högkvalitativ gas av HBr används för etsning och rengöring av halvledarråvara (SHOWA DENKO K.K, n.d.).
Föreningen används som ett analytiskt reagens vid bestämning av svavel, selen, vismut, zink och järn för separering av tenn från arsenik och antimon. Det är en alkyleringskatalysator och reduktionsmedel som används vid organisk syntes.
Vätebromid kan användas för produktion av bromvätesyra. Bromvätesyra är en mycket stark mineralsyra, starkare än saltsyra.
HBr är mycket reaktivt och frätande för de flesta metaller. Syra är ett vanligt reagens inom organisk kemi, som används för oxidation och katalys. Det är också effektivt vid extraktion av vissa metalliska mineraler (Hydrogen bromide, 2016).
Referenser
- Interscan Corporation. (2017). Vätebromid- och vätebromidövervakningsinstrument. Hämtad från gasdetection.com.
- Kemiskt datablad. (2016). Hämtad från HYDROGEN BROMIDE, ANHYDROUS: cameochemicals.noaa.gov.
- Egon Wiberg, N. W. (2001). Oorganisk kemi. Akademisk press.
- Vätebromid. (2016). Hämtad från ChemicalBook.
- Väte: vätebromid. (1993-2016). Hämtad från WebElements.
- Säkerhetsdatablad Vätebromid. (2005, 9 oktober). Hämtad från sciencelab.com.
- Nationellt centrum för bioteknikinformation. (S.F.). PubChem Compound Database; CID = 260. Hämtad från pubchem.ncbi.nlm.nih.gov.
- Praxair Inc. (2016, 17 oktober). Vätebromid, vattenfri säkerhetsdatablad P-4605. Hämtad från praxair.com.
- SHOWA DENKO K.K. (s.f.). vätebromid. Hämtad från www.sdk.co.jp.


Ingen har kommenterat den här artikeln än.