
Silverbromid (AgBr) struktur, egenskaper och användningsområden
De silverbromid det är ett oorganiskt salt vars kemiska formel är AgBr. Dess fasta substans består av katjoner Ag+ och br-anjoner- i ett förhållande 1: 1, lockat av elektrostatiska krafter eller jonbindningar. Det kan ses som om metalliskt silver hade gett en av sina valenselektroner till molekylärt brom.
Dess natur liknar dess "syskon" silverklorid och jodid. Alla tre salterna är olösliga i vatten, har liknande färger och är också känsliga för ljus. de genomgår fotokemiska reaktioner. Denna egenskap har använts för att erhålla fotografier till följd av minskningen av Ag-joner+ till metalliskt silver.
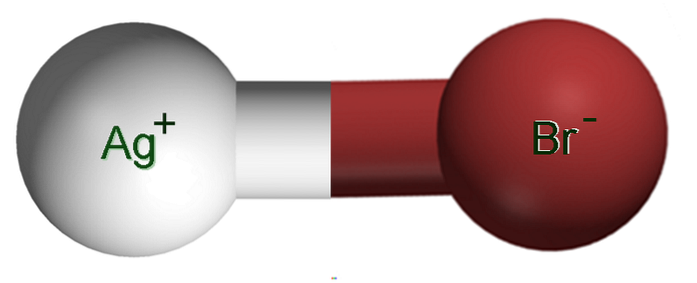
Bilden ovan visar ett jonpar Ag+Br-, där de vita och bruna kulorna motsvarar Ag-joner+ och Br-, respektive. Här representerar de den joniska bindningen som Ag-Br, men det är nödvändigt att indikera att det inte finns någon sådan kovalent bindning mellan båda jonerna.
Det kan verka motsägelsefullt att silver är det som bidrar med den svarta färgen till fotografier utan färg. Detta beror på att AgBr reagerar med ljus och genererar en latent bild; som sedan intensifieras genom att öka reduceringen av silver.
Artikelindex
- 1 Struktur av silverbromid
- 1.1 Kristallfel
- 2 Syntes
- 3 fastigheter
- 3.1 Utseende
- 3.2 Molekylär massa
- 3.3 Densitet
- 3.4 Smältpunkt
- 3.5 Kokpunkt
- 3.6 Löslighet i vatten
- 3.7 Brytningsindex
- 3.8 Värmekapacitet
- 3.9 Ljuskänslighet
- 4 användningsområden
- 5 Referenser
Struktur av silverbromid
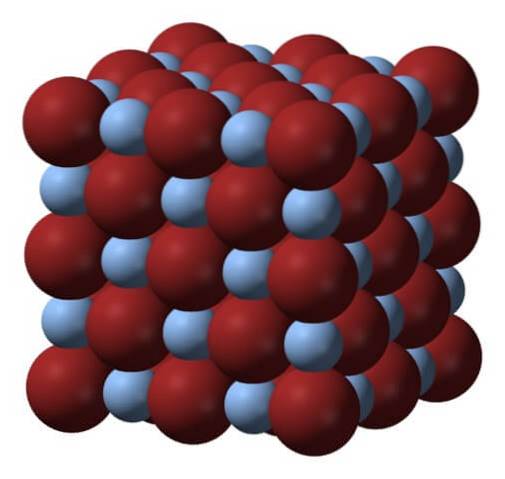
Ovan är galler eller kristallstruktur av silverbromid. Här är en mer trogen representation av skillnaden i storlek mellan de joniska radierna av Ag+ och Br-. Br anjoner-, mer voluminöst lämnar de mellanrum där Ag-katjonerna finns+, som är omgiven av sex Br- (och vice versa).
Denna struktur är karakteristisk för ett kubiskt kristallint system, speciellt av typen salt salt; samma till exempel som för natriumklorid, NaCl. I själva verket underlättar bilden detta genom att ordna en perfekt kubisk gräns.
Vid första anblicken kan man se att det finns en viss skillnad i storlek mellan jonerna. Detta och kanske de elektroniska egenskaperna hos Ag+ (och den möjliga effekten av vissa föroreningar) leder till AgBr-kristaller som visar defekter; det vill säga platser där ordningsföljden för joner i rymden är "trasig".
Kristallfel
Dessa defekter består av tomrum som lämnas av frånvarande eller förskjutna joner. Till exempel mellan sex br-anjoner- normalt ska katjonen Ag vara+; men istället kan det bli ett tomrum på grund av att silver har flyttat in i ett annat gap (Frenkel-defekt).
Även om de påverkar kristallgitteret, gynnar de reaktionerna av silver med ljus; och ju större kristallerna eller deras kluster (kornstorlek), desto större antal defekter, och därför kommer det att vara mer känsligt för ljus. På samma sätt påverkar föroreningar strukturen och denna egenskap, särskilt de som kan reduceras med elektroner..
Som en konsekvens av det senare kräver stora AgBr-kristaller mindre exponering för ljus för att reducera dem; de är mer önskvärda för fotografiska ändamål.
Syntes
I laboratoriet kan silverbromid syntetiseras genom att blanda en vattenlösning av silvernitrat, AgNO3, med saltet av natriumbromid, NaBr. Det första saltet bidrar med silver och det andra bromiden. Det som följer är en dubbelförskjutnings- eller metatesreaktion som kan representeras av den kemiska ekvationen nedan:
AgNO3(aq) + NaBr (s) => NaNO3(aq) + AgBr (s)
Observera att natriumnitratsaltet, NaNO3, den är löslig i vatten, medan AgBr fälls ut som ett fast ämne med en svag gul färg. Därefter tvättas det fasta ämnet och vakuumtorkas. Förutom NaBr kan KBr också användas som en källa för bromidanjoner.
Å andra sidan kan AgBr naturligt erhållas genom sin mineralbromirit och dess reningsprocesser..
Egenskaper
Utseende
Lerliknande, vitgult fast ämne.
Molekylär massa
187,77 g / mol.
Densitet
6,473 g / ml.
Smältpunkt
432 ° C.
Kokpunkt
1502 ° C.
Vattenlöslighet
0,140 g / ml vid 20 ° C.
Brytningsindex
2 253.
Värmekapacitet
270 J / kg K.
Känslighet mot ljus
Det sades i föregående avsnitt att det finns defekter i AgBr-kristaller som främjar känsligheten för detta salt för ljus, eftersom de fångar de bildade elektronerna; och sålunda förhindras de i teorin från att reagera med andra arter i miljön, såsom syre i luften.
Elektronen frigörs från Br-reaktionen- med en foton:
Br- + hv => 1 / 2Brtvå + och-
Observera att Br producerastvå, som fläckar det fasta röda om det inte tas bort. Släppta elektroner minskar Ag-katjoner+, i dess mellanrum, till metalliskt silver (ibland representerat som Ag0):
Ag+ + och- => Ag
Har då nätekvationen:
AgBr => Ag + 1 / 2Brtvå
När de "första skikten" av metalliskt silver bildas på ytan sägs det att det finns en latent bild, fortfarande osynlig för det mänskliga ögat. Denna bild blir miljontals gånger mer synlig om en annan kemisk art (såsom hydrokinon och fenidon, i utvecklingsprocessen) ökar minskningen av AgBr-kristallerna till metalliskt silver.
Applikationer

Silverbromid är den mest använda av alla halider inom området för fotografisk filmutveckling. AgBr appliceras på filmerna, tillverkade med cellulosaacetat, suspenderat i gelatin (fotografisk emulsion) och i närvaro av 4- (metylamino) fenolsulfat (Metol) eller fenidon och hydrokinon.
Med alla dessa reagenser kan den latenta bilden få liv; avsluta och påskynda omvandlingen av joniskt till metalliskt silver. Men om du inte fortsätter med viss omsorg och erfarenhet kommer allt silver på ytan att oxideras och kontrasten mellan de svarta och vita färgerna kommer att ta slut..
Det är därför det är viktigt att stoppa, fixera och tvätta doppstegen för fotografiska filmer..
Det finns konstnärer som leker med dessa processer på ett sådant sätt att de skapar gråtoner som berikar skönheten i bilden och deras eget arv; och de gör allt detta, ibland kanske utan att misstänka det, tack vare kemiska reaktioner, vars teoretiska grund kan bli lite komplex, och till en ljuskänslig AgBr som markerar en utgångspunkt.
Referenser
- Wikipedia. (2019). Silverbromid. Återställd från: en.wikipedia.org
- Michael W. Davidson. (2015, 13 november). Polarized Light Digital Image Gallery: Silverbromid. Olympus. Återställd från: micro.magnet.fsu.edu
- Crystran Ltd. (2012). Silverbromid (AgBr). Återställd från: crystran.co.uk
- Lothar Duenkel, Juergen Eichler, Gerhard Ackermann och Claudia Schneeweiss. (29 juni 2004). Självgjorda silverbromidbaserade emulsioner för användare i holografi: tillverkning, bearbetning och applicering, Proc. SPIE 5290, Practical Holography XVIII: Materials and Applications; doi: 10.1117 / 12.525035; https://doi.org/10.1117/12.525035
- Alan G. Form. (1993). Oorganisk kemi. (Andra upplagan.). Redaktionellt Reverté.
- Carlos Güido och Ma Eugenia Bautista. (2018). Introduktion till fotografisk kemi. Återställd från: fotografia.ceduc.com.mx
- García D. Bello. (9 januari 2014). Kemi, fotografi och Chema Madoz. Återställd från: dimetylsulfuro.es


Ingen har kommenterat den här artikeln än.