
Butanonstruktur, egenskaper och användningsområden
De butanon är en organisk förening, specifikt en keton, vars kemiska formel är CH3CHtvåBil3. Dess utseende är som en färglös vätska som främst används som lösningsmedel. Har egenskaper som liknar aceton, men kokar vid högre temperatur och avdunstar långsammare.
Det produceras genom katalytisk dehydrogenering av 2-butanol (kiral förening). Det finns dock i sitt naturliga tillstånd i sammansättningen av vissa frukter. Det är en del av ångorna från fordonens avgasrör och är en del av tobaksrök.
Det är efter aceton den enklaste av denna familj av organiska föreningar. Butanon orsakar irritation i ögon och näsa. Vid ovanligt höga doser kan det orsaka irritation i lungslemhinnan. Å andra sidan anses denna vätska vara ett föregångare för narkotika..
Butanon har stor löslighet i vatten; men det är också mycket lösligt i organiska lösningsmedel såsom etanol, eter, aceton, bensen och kloroform. Detta kan förklaras eftersom din logg för P (0,29) -värdet för oktan / vatten-fördelningskoefficienten är låg.
Artikelindex
- 1 Struktur av butanon
- 2 fastigheter
- 2.1 Molekylformel
- 2.2 Namn
- 2.3 Molmassa
- 2.4 Fysisk beskrivning
- 2,5 Lukt
- 2.6 Kokpunkt
- 2.7 Smältpunkt
- 2.8 Flampunkt
- 2.9 Löslighet i vatten
- 2.10 Löslighet i organiska lösningsmedel
- 2.11 Densitet
- 2.12 Ångdensitet
- 2.13 Ångtryck
- 2.14 Fördelningskoefficient oktanol / vatten
- 2.15 Självantändningstemperatur
- 2.16 Sönderfall
- 2.17 Viskositet
- 2.18 Förbränningsvärme
- 2.19 Förångningsvärme
- 2.20 Ytspänning
- 2.21 Joniseringspotential
- 2.22 Lukttröskel
- 2.23 Brytningsindex
- 2.24 Dissociationskonstant
- 2.25 Stabilitet
- 3 användningsområden
- 3.1 Lösningsmedel
- 3.2 Reagens
- 3.3 Plastcement
- 3.4 Andra användningsområden
- 4 Referenser
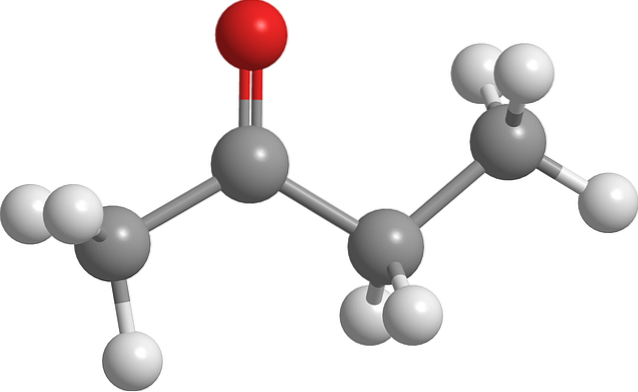
Struktur av butanon
Bilden ovan visar butanonmolekylen med en kul-och-stick-modell. Syreatom i karbonylgruppen (röd sfär) kan ses på det andra kolet. Denna grupp, C = O, är ansvarig för att ge molekylen ett permanent dipolmoment.
Butanon, strukturellt sett, är inget annat än en aceton till vilken en metylengrupp, CHtvå. Eftersom det finns fler kol, är dipolmomentet mindre jämfört med aceton; men dess högre molekylvikt gör att den kokar vid en högre temperatur.
Denna molekyl, liksom andra ketoner, saknar förmågan att bilda vätebindningar; och därför är deras dipol-dipolinteraktioner inte lika starka.
Det är därför det är en flyktig vätska. När temperaturen sjunker (-86,6 ° C) är dess svaga dipoler de som orienterar dess molekyler på ett ordnat sätt för att bilda en kristall. Utöver detta kan det också kommenteras att butanon är strukturellt asymmetrisk.
Egenskaper
Molekylär formel
C4H8O eller CH3BiltvåCH3
Namn
- Butanon.
- 2-butanon.
- Butan-2-one.
- Metyletylketon.
Molmassa
72,107 g / mol.
Fysisk beskrivning
Färglös vätska.
Odör
Mint doftande, måttligt stark.
Kokpunkt
79,59 ° C vid 760 mmHg.
Smältpunkt
-86,6 ºC.
antändningspunkt
-9 ºC (sluten kopp).
Vattenlöslighet
29 g / 100 ml vid 20 ° C Även om dess dipolmoment är mindre än för aceton, kan det fortfarande interagera i utmärkt grad med vattenmolekyler. Från dem får den vätebindningar: (CH3(CHtvåCH3C = O-HOH. På grund av detta är det mycket lösligt i vatten.
Löslighet i organiska lösningsmedel
Lösligt i bensen, alkohol och eter; Blandbar med oljor, etanol, eter, aceton, bensen och kloroform. Observera att butanon är lösligt i en mängd olika lösningsmedel.
Densitet
0,7997 g / cm3 vid 25 ºC.
Ång-densitet
2,41 (relativt vatten = 1).
Ångtryck
90,6 mmHg vid 25 ºC.
Fördelningskoefficient oktanol / vatten
Logg P = 0,29
Självantändningstemperatur
505 ºC.
Sönderfall
Det sönderdelas genom fotokemiska processer genom oxidation genom fria hydroxylradikaler, liksom genom direkt fotolysnedbrytning. Vid uppvärmning till nedbrytning avger den skarp rök.
Viskositet
0,40 cPoise vid 25 ° C.
Förbränningsvärme
2 444,1 kJ / mol vid 25 ºC.
Förångningsvärme
31.30 kJ / mol vid kokpunkten; och 34,79 kJ / mol vid 25 ° C.
Ytspänning
23,97 mN / m vid 25 ºC.
Joniseringspotential
0,54 eV.
Lukttröskel
Låg lukt: 0,735 mg / m3.
Hög lukt: 147,5 mg / m3.
Brytningsindex
1788 vid 20 ºC.
Dissociationskonstant
pKa = 14,70.
Stabilitet
Stabil, men mycket brandfarlig. Oförenlig med starka oxidationsmedel, baser och reduktionsmedel. Fukt bör undvikas.
Applikationer
Lösningsmedel
Butanon används som lösningsmedel vid tillverkning av ytbeläggningar, tillverkning av rökfria pulver, tillverkning av färgade hartser och vid avlägsnande av fettansamling producerad av smörjmedel..
Dessutom används den vid utarbetandet av:
- Konstgjort läder.
- Gummi.
- Lacker.
- Lack.
- Lim.
- Lösningsmedel.
- Färgborttagare.
- Lim.
- Plastcement.
- Tätningsmedel.
- Magnetband.
- Transparent papper.
- Tryckfärger.
- Kosmetika och läkemedel.
Det används också som lösningsmedel för avfettning av metallytor, rengöringsmedel för elektronisk utrustning och fettutsug. Den används för utvinning av lövträ och vegetabilisk olja.
Det är en inert ingrediens vid tillverkning av bekämpningsmedel och vid tillverkning av cellulosaacetat och cellulosanitrat.
Det används som extraktionslösningsmedel vid bearbetning av livsmedel och livsmedelsingredienser; till exempel vid fraktionering av fetter och oljor, liksom i koffeinprocessen av kaffe. Används också som lösningsmedel i markörer som används på whiteboards.
Reagens
- Butanon används som en vattenlöslig fotoinitiator för fotopolymerisation av metakrylsyra..
- Det kondenseras med formaldehyd för att producera isopropenylketon.
- Upplever självkondensation för produktion av etylamylketon.
- Reagerar med citral för att erhålla parfymkomponenter såsom metylpseudojonon.
- Går in som katalysator i produktionen av hydrazin.
- Dessutom är det en föregångare till metyletylketonperoxid, som är en katalysator för vissa polymerisationsreaktioner..
Plastcement
Butanon har applikation som ett plastsvetsmedel, med användning vid montering av polystyrenskalamodeller. Butanon löser upp polystyren, vilket gör att kanterna kan komma ihop när en ny polymerisation inträffar. Detta beteende är av cement och inte av lim.
Andra användningsområden
Butanon används som en bakteriell sporsterilisator i kirurgiska instrument, nålar, injektionsinjektorer och tandinstrument..
Det används som livsmedelssmakämne i mycket låga koncentrationer; i alkoholhaltiga drycker är till exempel koncentrationen 20 ppm; i bakade produkter, 12,7 ppm; kött har cirka 26,5 ppm; tuggummi, 0,63 ppm; och i fetter och oljor, 1,0 ppm.
Och slutligen används butanon vid separationen av apoproteinet från hemgruppen i hemeproteinerna..
Referenser
- Morrison, R. T. och Boyd, R, N. (1987). Organisk kemi. 5ta Utgåva. Ledare Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10thutgåva.). Wiley plus.
- Nationellt centrum för bioteknikinformation. (2019). Metyletylketon PubChem Database. CID = 6569. Återställd från: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Butanon. Återställd från: en.wikipedia.org
- Royal Society of Chemistry. (2015). Butanon. Chemspider. Återställd från: chemspider.com
- Arlem Cheprasov. (2019). Vad är butanon? Formel och användningsområden. Studie. Återställd från: study.com
- Vasler Ben. (17 maj 2017). Butanon. Chemistry World. Återställd från: chemistryworld.com



Ingen har kommenterat den här artikeln än.