
Butenegenskaper, kemisk struktur och användningsområden
De buten är namnet på en serie av fyra isomerer med den kemiska formeln C4H8. De är alkener eller olefiner, det vill säga de har en C = C dubbelbindning i sin struktur. Dessutom är de kolväten, som kan hittas i oljefält eller härrör från termisk krackning och erhåller produkter med lägre molekylvikt..
De fyra isomererna reagerar med syre, släpper ut värme och en gul flamma. På samma sätt kan de reagera med ett brett spektrum av små molekyler som ökar deras dubbelbindning..
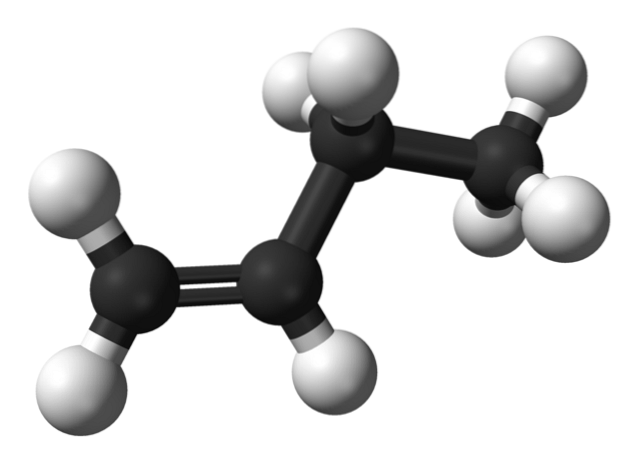
Men vilka är isomererna av buten? I den övre bilden representeras strukturen med vita (väte) och svarta (kol) kulor för 1-buten. 1-buten är den enklaste isomeren av kolväten C4H8. Observera att det finns åtta vita sfärer och fyra svarta sfärer, vilket överensstämmer med den kemiska formeln.
De andra tre isomererna är cis och trans 2-buten och iso-buten. Alla uppvisar mycket liknande kemiska egenskaper, även om deras strukturer orsakar variationer i fysikaliska egenskaper (smält- och kokpunkter, densiteter etc.). Dessutom har deras IR-spektra liknande mönster av absorptionsband..
I allmänhet benämns 1-buten som buten, även om 1-buten endast hänvisar till en enda isomer och inte till ett generiskt namn. Dessa fyra organiska föreningar är gaser, men de kan smälta vid höga tryck eller kondensera (och till och med kristallisera) med en temperaturminskning..
De är en värmekälla och energi, reagenser för syntes av andra organiska föreningar och framför allt nödvändiga för tillverkning av konstgjord gummi efter syntes av butadien..
Artikelindex
- 1 Egenskaper för buten
- 1.1 Molekylvikt
- 1.2 Fysiska aspekter
- 1.3 Kokpunkt
- 1.4 Smältpunkt
- 1.5 Löslighet
- 1.6 Densitet
- 1.7 Reaktivitet
- 2 Kemisk struktur
- 2.1 Konstitutionella och geometriska isomerer
- 2.2 Stabilitet
- 2.3 Intermolekylära krafter
- 3 användningsområden
- 4 Referenser
Butene egenskaper
Molekylvikt
56,106 g / mol. Denna vikt är densamma för alla isomerer med formel C4H8.
Fysiska aspekter
Det är en färglös och brandfarlig gas (som de andra isomererna) och har en relativt aromatisk lukt..
Kokpunkt
Kokpunkterna för isomererna av buten är som följer:
1-buten: -6 ° C
Cis-2-buten: 3,7 ° C
Trans-2-buten: 0,96 ° C
2-metylpropen: -6,9 ° C
Smältpunkt
1-buten: -185,3 ° C
Cis-2-buten: -138,9 ° C
Trans-2-buten: -105,5 ° C
2-metylpropen: -140,4 ° C
Löslighet
Buten är mycket olösligt i vatten på grund av dess opolära natur. Det löser sig dock perfekt i vissa alkoholer, bensen, toluen och etrar..
Densitet
0,577 vid 25 ° C Därför är den mindre tät än vatten och i en behållare skulle den vara placerad ovanför den..
Reaktivitet
Liksom alla alken är dess dubbelbindning mottaglig för tillsats av molekyler eller oxidering. Detta gör buten och dess isomerer reaktiva. Å andra sidan är de brandfarliga ämnen, så när de överhettas reagerar de med syret i luften..
Kemisk struktur
I den övre bilden representeras strukturen för 1-Butene. Till vänster kan du se placeringen av dubbelbindningen mellan det första och det andra kolet. Molekylen har en linjär struktur, även om regionen runt C = C-bindningen är platt på grund av sp-hybridiseringtvå av dessa kol.
Om 1-butenmolekylen roterades i en vinkel på 180º, skulle den ha samma molekyl utan uppenbara förändringar, därför saknar den optisk aktivitet.
Hur skulle dess molekyler interagera? C-H-, C = C- och C-C-bindningarna är apolära till sin natur, så ingen av dem samarbetar i bildandet av ett dipolmoment. Följaktligen har molekylerna CHtvå= CHCHtvåCH3 måste interagera med hjälp av Londons spridningskrafter.
Den högra änden av buten bildar momentana dipoler, som på kort avstånd polariserar angränsande atomer i en angränsande molekyl. För sin del samverkar den vänstra änden av C = C-bindningen genom att överlagra π-molnen ovanpå varandra (som två skivor eller ark).
Eftersom det finns fyra kolatomer som utgör det molekylära skelettet är deras interaktioner knappt tillräckliga för att vätskefasen ska ha en kokpunkt på -6 ° C..
Konstitutionella och geometriska isomerer
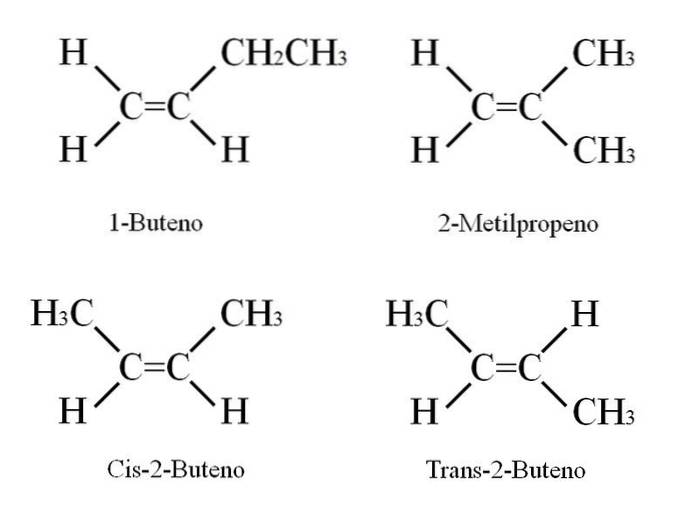
1-buten har molekylformeln C4H8; Andra föreningar kan emellertid ha samma andel C- och H-atomer i sin struktur..
Hur är det möjligt? Om strukturen för 1-buten observeras noggrant kan substituenterna på C = C-kolerna bytas ut. Detta utbyte producerar andra föreningar från samma skelett. Dessutom kan positionen för dubbelbindningen mellan C-1 och C-2 flyttas mot C-2 och C-3: CH3CH = CHCH3, 2-buten.
I 2-buten kan H-atomerna vara placerade på samma sida av dubbelbindningen, vilket motsvarar cis-stereoisomeren; eller i en motsatt rumslig orientering, i trans-stereoisomeren. Båda utgör så kallade geometriska isomerer. Detsamma gäller för -CH-grupper3.
Observera också att om det lämnades i CH-molekylen3CH = CHCH3 H-atomerna på ena sidan och CH-grupperna3 i en annan skulle en konstitutionell isomer erhållas: CHtvå= C (CH3)två, 2-metylpropen (även känd som isobuten).
Dessa fyra föreningar har samma formel C4H8 men olika strukturer. 1-buten och 2-metylpropen är konstitutionella isomerer; och cis och trans-2-buten, geometriska isomerer mellan dem två (och konstitutionella med avseende på resten).
Stabilitet
Förbränningsvärme
Från bilden ovan, vilken av de fyra isomererna representerar den mest stabila strukturen? Svaret finns till exempel i förbränningsvärmen hos var och en av dem. Genom att reagera med syre, är isomeren med formel C4H8 förvandlas till COtvå släppa ut vatten och värme:
C4H8(g) + 6Otvå(g) => 4COtvå(g) + 4HtvåO (g)
Förbränningen är exoterm, så ju mer värme som släpps ut, desto mer instabilt är kolvätet. Därför kommer den av de fyra isomererna som släpper ut minst värme när den brinner i luft att vara den mest stabila..
Förbränningsvärmen för de fyra isomererna är:
-1-buten: 2717 kJ / mol
-cis-2-buten: 2710 kJ / mol
-trans-2-buten: 2707 kJ / mol
-2-metylpropen: 2700 kJ / mol
Observera att 2-metylpropen är den isomer som ger minst värme. Medan 1-Butene är den som släpper ut mer värme, vilket översätts till större instabilitet.
Sterisk och elektronisk effekt
Denna skillnad i stabilitet mellan isomererna kan härledas direkt från den kemiska strukturen. Enligt alkenerna får den som har fler R-substituenter större stabilisering av sin dubbelbindning. Således är 1-buten den mest instabila eftersom den knappast har en substituent (-CHtvåCH3); det vill säga det är monosubstituerat (RHC = CHtvå).
Cis- och trans-isomererna av 2-buten skiljer sig åt i energi på grund av Van der Wall-spänningen orsakad av den steriska effekten. I cis-isomeren är de två CH-grupperna3 på samma sida av dubbelbindningen stöter de från varandra, medan de i trans-isomeren är tillräckligt långt ifrån varandra.
Men varför är 2-metylpropen den mest stabila isomeren? Eftersom den elektroniska effekten går in.
I detta fall, även om det är en disubstituerad alken, de två CH-grupperna3 de är på samma kol; i ursprunglig position relativt varandra. Dessa grupper stabiliserar dubbelbindningens kol, vilket ger den en del av sitt elektronmoln (eftersom det är relativt surare på grund av sp-hybridisering).två).
Dessutom har de två isomererna i 2-buten endast 2º kol; medan 2-metylpropen innehåller ett tredje kol, med större elektronisk stabilitet.
Intermolekylära krafter
Stabiliteten hos de fyra isomererna följer en logisk ordning, men de intermolekylära krafterna gör det inte. Om deras smält- och kokpunkter jämförs, kommer det att konstateras att de inte följer samma ordning.
Det kan förväntas att trans-2-buten skulle uppvisa de högsta intermolekylära krafterna på grund av att ha större ytkontakt mellan två molekyler, till skillnad från cis-2-buten, vars skelett drar en C. Emellertid kokar cis-2-buten vid högre temperatur (3,7 ° C) än trans-isomeren (0,96 ° C).
Liknande kokpunkter för 1-buten och 2-metylpropen kan förväntas eftersom de är strukturellt mycket lika. Men i fast tillstånd förändras skillnaden radikalt. 1-buten smälter vid -185,3 ° C, medan 2-metylpropen vid -140,4 ° C.
Dessutom smälter cis-2-buten-isomeren vid -138,9 ° C, vid en temperatur mycket nära 2-metylpropenom, vilket kan innebära att i det fasta materialet uppvisar de ett lika stabilt arrangemang.
Av dessa data kan man dra slutsatsen att de, trots att de känner till de mest stabila strukturerna, inte belyser kunskapen om hur intermolekylära krafter fungerar i vätskan; och ännu mer, i den fasta fasen av dessa isomerer.
Applikationer
-Butener, med tanke på deras förbränningsvärme, kan helt enkelt användas som värmekälla eller bränsle. Således skulle 1-butenflamman förväntas värmas upp mer än för de andra isomererna..
-Kan användas som organiska lösningsmedel.
-De fungerar som tillsatser för att höja oktanhalten av bensin.
-Inom organisk syntes deltar 1-buten i produktionen av andra föreningar såsom: butylenoxid, 2-glutanol, succinimid och tert-butylmecaptan (används för att ge kokgas sin karakteristiska lukt). På samma sätt butadien (CHtvå= CH-CH = CHtvå), från vilken konstgjord gummi syntetiseras.
Utöver dessa synteser kommer produkternas mångfald att bero på vilka molekyler som läggs till dubbelbindningen. Exempelvis kan alkylhalogenider syntetiseras om de reageras med halogener; alkoholer, om de tillsätter vatten i ett surt medium; och tert-butylestrar om de tillsätter alkoholer med låg molekylvikt (såsom metanol).
Referenser
- Francis A. Carey. Organisk kemi. Karboxylsyror. (sjätte upplagan, sidorna 863-866). Mc Graw Hill.
- Wikipedia. (2018). Butene Hämtad från: es.wikipedia.org
- YPF. (Juli 2017). Buten oss. [PDF]. Hämtad från: ypf.com
- William Reusch. (5 maj 2013). Tilläggsreaktioner från Alkenes. Återställd från: 2.chemistry.msu.edu
- PubChem. (2018). 1-Buten. Återställd från: pubchem.ncbi.nlm.nih.gov



Ingen har kommenterat den här artikeln än.