
Elektrolys av vattenförfarande, tekniker, vad det är för
De elektrolys av vatten Det är nedbrytningen av vatten i dess elementkomponenter genom applicering av en elektrisk ström. När du fortsätter, väte och molekylärt syre, Htvå migtvå. Dessa två ytor är bättre kända under namnet elektroder..
Teoretiskt sett är volymen av Htvå bildas måste vara dubbelt så stor som Otvå. Varför? Eftersom vattenmolekylen har ett H / O-förhållande lika med 2, det vill säga två H för varje syre. Detta förhållande bekräftas direkt med dess kemiska formel, HtvåO. Men många experimentella faktorer påverkar de erhållna volymerna.

Om elektrolysen utförs i rör nedsänkta i vatten (övre bild) motsvarar den nedre kolonnen vatten väte, eftersom det finns en större mängd gas som utövar tryck på vätskans yta. Bubblorna omger elektroderna och slutar stiga efter att ha övervunnit vattenets ångtryck.
Observera att rören är åtskilda från varandra på ett sådant sätt att det är låg gasmigrering från en elektrod till en annan. I låg skala utgör detta inte en överhängande risk; men på industriella vågar, den gasformiga blandningen av Htvå migtvå det är mycket farligt och explosivt.
Av denna anledning är de elektrokemiska cellerna där elektrolysen av vatten utförs mycket dyra; De behöver en design och element som säkerställer att gaser aldrig blandas, en kostnadseffektiv strömförsörjning, höga koncentrationer av elektrolyter, speciella elektroder (elektrokatalysatorer) och mekanismer för att lagra Htvå produceras.
Elektrokatalysatorer representerar friktion och samtidigt vingar för lönsamhet för elektrolys av vatten. Vissa består av ädelmetalloxider, såsom platina och iridium, vars priser är mycket höga. Det är vid denna tidpunkt särskilt där forskare går samman för att utforma effektiva, stabila och billiga elektroder..
Anledningen till dessa ansträngningar är att påskynda bildandet av Otvå, som sker vid lägre hastigheter jämfört med Htvå. Detta saktar ner av elektroden där O bildastvå det medför som en allmän konsekvens tillämpningen av en potential som är mycket större än nödvändigt (överpotential); vad är detsamma, till lägre resultat och högre kostnader.
Artikelindex
- 1 Elektrolysreaktion
- 1.1 Halvcellsreaktioner
- 2 Förfarande
- 3 tekniker
- 3.1 Elektrolys med alkaliskt vatten
- 3.2 Elektrolys med elektrolytiskt polymermembran
- 3.3 Elektrolys med fasta oxider
- 4 Vad är elektrolysen av vatten för?
- 4.1 Väteproduktion och dess användning
- 4.2 Som en felsökningsmetod
- 4.3 Som syretillförsel
- 5 Hemexperiment
- 5.1 Hemvariabler
- 6 Referenser
Elektrolysreaktion
Elektrolysen av vatten involverar många komplexa aspekter. Generellt sett vilar dess grund dock på en enkel global reaktion:
2HtvåO (l) => 2Htvå(g) + Otvå(g)
Som framgår av ekvationen är två vattenmolekyler inblandade: en måste vanligtvis reduceras eller få elektroner, medan den andra måste oxidera eller förlora elektroner..
Htvå Det är en produkt av minskningen av vatten, eftersom vinsten av elektroner främjar att H-protonerna+ kan binda kovalent och syret omvandlas till OH-. Därför är Htvå uppträder vid katoden, vilket är elektroden där reduktion sker.
Medan Otvå kommer från oxidationen av vatten, på grund av vilken den förlorar elektronerna som gör att den kan binda till väte och frisätter följaktligen protoner H+. Otvå den produceras vid anoden, elektroden där oxidation sker; och till skillnad från den andra elektroden är pH runt anoden sur och inte basisk.
Halvcellsreaktioner
Detta kan sammanfattas med följande kemiska ekvationer för halvcellsreaktioner:
2HtvåO + 2e- => Htvå + 2OH- (Katod, grundläggande)
2HtvåO => Otvå + 4H+ + 4e- (Anod, syra)
Vatten kan dock inte förlora fler elektroner (4e-) av vilken den andra vattenmolekylen vinner vid katoden (2e-); därför måste den första ekvationen multipliceras med 2 och sedan subtraheras med den andra ekvationen för att erhålla nätekvationen:
2 (2HtvåO + 2e- => Htvå + 2OH-)
2HtvåO => Otvå + 4H+ + 4e-
6HtvåO => 2Htvå + ELLERtvå + 4H+ + 4OH-
Men 4H+ och 4OH- form 4HtvåEller så tar dessa bort fyra av de sex molekylerna av HtvåEller lämnar två; och resultatet är den globala reaktion som just tagits upp.
Halvcellsreaktioner förändras med pH-värden, tekniker och har också associerade reduktions- eller oxidationspotentialer, som avgör hur mycket ström som behövs för att elektrolysen av vatten ska gå spontant..
Bearbeta
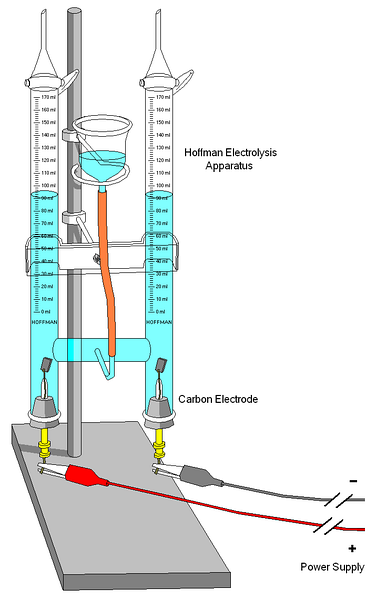
En Hoffman voltameter visas i bilden ovan. Cylindrarna är fyllda med vatten och de valda elektrolyterna genom mittmunstycket. Dessa elektrolyters roll är att öka konduktiviteten hos vattnet, eftersom det under normala förhållanden är mycket få H-joner3ELLER+ och OH- produkter av dess självjonisering.
De två elektroderna är vanligtvis platina, även om de i bilden ersattes av kolelektroder. Båda är anslutna till ett batteri, med vilket en potentialskillnad (AV) appliceras som främjar oxidationen av vatten (bildning av Otvå).
Elektronerna färdas hela kretsen tills de når den andra elektroden, där vattnet vinner dem och blir Htvå och OH-. Vid denna punkt är anoden och katoden redan definierade, vilket kan särskiljas av höjden på vattenpelarna; den med den lägsta höjden motsvarar katoden där H bildastvå.
På toppen av cylindrarna finns det nycklar som gör att de genererade gaserna kan släppas ut. Närvaron av H kan noggrant kontrollerastvå vilket gör att den reagerar med en flamma vars förbränning ger gasformigt vatten.
Tekniker
Vattenelektrolystekniker varierar beroende på mängden Htvå migtvå som föreslås generera. Båda gaserna är mycket farliga om de blandas tillsammans, varför elektrolytiska celler involverar komplexa konstruktioner för att minimera ökningen av gastryck och deras diffusion genom det vattenhaltiga mediet..
På samma sätt varierar teknikerna beroende på cellen, elektrolyten som tillsätts vattnet och elektroderna själva. Å andra sidan antyder vissa att reaktionen utförs vid högre temperaturer, vilket minskar elförbrukningen, och andra använder enorma tryck för att bibehålla Htvå lagrad.
Bland alla tekniker kan följande tre nämnas:
Elektrolys med alkaliskt vatten
Elektrolys utförs med basiska lösningar av alkalimetallerna (KOH eller NaOH). Med denna teknik uppstår reaktionerna:
4HtvåO (l) + 4e- => 2Htvå(g) + 4OH-(ac)
4OH-(ac) => Otvå(g) + 2HtvåO (l) + 4e-
Som kan ses, både vid katoden och vid anoden, har vatten ett basiskt pH; och vidare OH- migrera till anoden där de oxiderar till Otvå.
Elektrolys med elektrolytiskt polymermembran
Denna teknik använder en fast polymer som fungerar som ett permeabelt membran för H+, men ogenomtränglig för gaser. Detta säkerställer större säkerhet vid elektrolys..
Halvcellsreaktionerna för detta fall är:
4H+(ac) + 4e- => 2Htvå(g)
2HtvåO (l) => Otvå(g) + 4H+(ac) + 4e-
H-joner+ migrera från anoden till katoden, där de reduceras till att bli Htvå.
Elektrolys med fasta oxider
Mycket annorlunda än andra tekniker, den här använder oxider som elektrolyter, som vid höga temperaturer (600-900 ° C) fungerar som ett transportmedel för anjonen Otvå-.
Reaktionerna är:
2HtvåO (g) + 4e- => 2Htvå(g) + 20två-
2Otvå- => Otvå(g) + 4e-
Observera att den här gången är oxidanjoner, Otvå-, de som reser till anoden.
Vad är elektrolysen av vatten för?
Elektrolysen av vatten ger Htvå (g) och Otvå (g). Cirka 5% av den vätgas som produceras i världen tillverkas genom elektrolys av vatten.
Htvå det är en biprodukt från elektrolysen av vattenhaltiga NaCl-lösningar. Närvaron av salt underlättar elektrolys genom att öka vattenets elektriska konduktivitet.
Den övergripande reaktionen som äger rum är:
2NaCl + 2HtvåO => Cltvå + Htvå + 2NaOH
För att förstå den enorma betydelsen av denna reaktion kommer några av användningarna av gasformiga produkter att nämnas; För i slutet av dagen är det dessa som driver utvecklingen av nya metoder för att uppnå elektrolys av vatten på ett mer effektivt och grönt sätt.
Av alla är det mest önskvärda att fungera som celler som energiskt ersätter användningen av brinnande fossila bränslen..
Väteproduktion och dess användning
-Väte som produceras i elektrolys kan användas i den kemiska industrin som verkar i missbruksreaktioner, i hydreringsprocesser eller som ett reduktionsmedel i reduktionsförfaranden.
-På samma sätt är det viktigt i vissa åtgärder av kommersiell betydelse, såsom: produktion av saltsyra, väteperoxid, hydroxylaminer, etc. Det är involverat i syntesen av ammoniak genom en katalytisk reaktion med kväve.
-I kombination med syre producerar den flammor med högt kaloriinnehåll, med temperaturer mellan 3000 och 3500 K. Dessa temperaturer kan användas för skärning och svetsning inom metallindustrin, för tillväxt av syntetiska kristaller, produktion av kvarts etc..
-Vattenbehandling: för högt nitratinnehåll i vatten kan reduceras genom eliminering i bioreaktorer, där bakterier använder väte som energikälla
-Väte är involverat i syntesen av plast, polyester och nylon. Dessutom ingår det i produktionen av glas, vilket ökar förbränningen under bakning..
-Reagerar med oxider och klorid av många metaller, inklusive: silver, koppar, bly, vismut och kvicksilver för att producera rena metaller.
-Dessutom används den som bränsle vid kromatografisk analys med en flamdetektor..
Som en felsökningsmetod
Elektrolysen av natriumkloridlösningar används för att rena poolvatten. Under elektrolys produceras väte vid katoden och klor (Cltvå) vid anoden. Elektrolys kallas i detta fall saltklorinator.
Klor löses i vatten för att bilda hypoklorsyra och natriumhypoklorit. Hypoklorsyra och natriumhypoklorit steriliserar vatten.
Som syretillförsel
Elektrolysen av vatten används också för att generera syre på den internationella rymdstationen, som tjänar till att upprätthålla en syreatmosfär i stationen..
Väte kan användas i en bränslecell, en metod för att lagra energi och använda vattnet som genereras i cellen för konsumtion av astronauter.
Hemexperiment
Vattenelektrolysexperiment har utförts i laboratorievågar med Hoffman voltmetrar eller en annan enhet som gör det möjligt att innehålla alla nödvändiga element i en elektrokemisk cell..
Av alla möjliga sammansättningar och utrustning kan det enklaste vara en stor transparent vattenbehållare, som kommer att fungera som en cell. Utöver detta måste alla metall- eller elektriskt ledande ytor också finnas till hands för att fungera som elektroder; en för katoden och den andra för anoden.
För detta ändamål kan till och med pennor med skarpa grafitspetsar i båda ändar vara användbara. Och slutligen ett litet batteri och några kablar som ansluter det till de improviserade elektroderna..
Om det inte utförs i en transparent behållare skulle bildandet av gasformiga bubblor inte uppskattas..
Hemvariabler
Även om elektrolys av vatten är ett ämne som innehåller många spännande och hoppfulla aspekter för dem som letar efter alternativa energikällor, kan hemmet experiment vara tråkigt för barn och andra åskådare..
Därför kan tillräcklig spänning appliceras för att generera bildandet av Htvå migtvå alternera vissa variabler och notera ändringarna.
Den första av dessa är variationen i pH-värdet i vattnet, med antingen ättika för att sura vattnet eller NatvåCO3 för att göra det lite lättare. En förändring måste ske i antalet bubblor som observerats.
Dessutom kan samma experiment upprepas med varmt och kallt vatten. På detta sätt skulle då effekten av temperaturen på reaktionen övervägas..
Slutligen, för att göra datainsamlingen lite mindre färglös, kan en mycket utspädd lösning av lila kåljuice användas. Denna juice är en syrabasindikator av naturligt ursprung.
Om du lägger till den i behållaren med de insatta elektroderna kommer det att märkas att vid anoden blir vattnet rosa (syra), medan vid katoden blir färgen gul (grundläggande).
Referenser
- Wikipedia. (2018). Elektrolys av vatten. Återställd från: en.wikipedia.org
- Chaplin M. (16 november 2018). Elektrolys av vatten. Vattenstruktur och vetenskap. Återställd från: 1.lsbu.ac.uk
- Energieffektivitet & förnybar energi. (s.f.). Väteproduktion: elektrolys. Återställd från: energy.gov
- Phys.org. (14 februari 2018). Högeffektiv, billig katalysator för vattenelektrolys. Återställd från: phys.org
- Kemi LibreTexts. (18 juni 2015). Elektrolys av vatten. Återställd från: chem.libretexts.org
- Xiang C., M. Papadantonakisab K. och S. Lewis N. (2016). Principer och implementeringar av elektrolyssystem för vattenuppdelning. Royal Society of Chemistry.
- Regents vid University of Minnesota. (2018). Elektrolys av vatten 2. University of Minnesota. Återställd från: chem.umn.edu



Ingen har kommenterat den här artikeln än.