
Primära kolegenskaper, typer och exempel
De primärt kol Det är en som i vilken förening som helst, oavsett dess molekylära miljö, bildar en bindning med minst en annan kolatom. Denna bindning kan vara enkel, dubbel (=) eller trippel (≡), så länge det bara finns två kolatomer kopplade och i intilliggande positioner (logiskt).
Vätena som finns på detta kol kallas primära väten. De kemiska egenskaperna hos de primära, sekundära och tertiära vätena skiljer sig emellertid lite och är övervägande utsatta för kolens molekylära miljöer. Det är av denna anledning som primärt kol (1 °) vanligtvis behandlas med mer betydelse än dess väten.
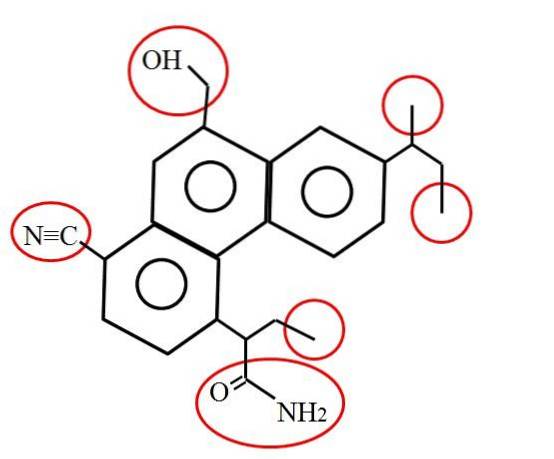
Och hur ser ett primärt kol ut? Svaret beror, som nämnts, på din molekylära eller kemiska miljö. Exempelvis indikerar bilden ovan de primära kolerna, inneslutna i röda cirklar, i strukturen för en hypotetisk (men förmodligen verklig) molekyl..
Om du tittar noga ser du att tre av dem är identiska; medan de andra tre är helt olika. De första tre består av metylgrupper, -CH3 (till höger om molekylen), och de andra är metylolgrupperna, -CHtvåOH, nitril, -CN och en amid, RCONHtvå (till vänster om molekylen och under den).
Artikelindex
- 1 Egenskaper för primärt kol
- 1.1 Plats och länkar
- 1.2 Lågt steriskt hinder
- 1.3 Reaktivitet
- 2 typer
- 3 Exempel
- 3.1 Aldehyder och karboxylsyror
- 3.2 I linjära aminer
- 3.3 I alkylhalogenider
- 4 Referenser
Kännetecken för primärt kol
Plats och länkar
Sex primära kolartiklar visades ovan, utan någon annan kommentar än deras placering och vilka andra atomer eller grupper som åtföljer dem. De kan vara var som helst i strukturen, och var de än befinner sig markerar de "vägens ände"; det vill säga där en del av skelettet slutar. Det är därför de ibland kallas terminala kol..
Således är det uppenbart att grupperna -CH3 de är terminala och deras kol är 1 °. Observera att detta kol binder till tre väten (som har utelämnats på bilden) och till ett enda kol, och kompletterar deras respektive fyra bindningar..
Därför kännetecknas de alla av att ha en C-C-bindning, en bindning som också kan vara dubbel (C = CHtvå) eller trippel (C≡CH). Detta förblir sant även om det finns andra atomer eller grupper kopplade till dessa kol; som med de övriga tre kvarvarande 1 ° kolerna i bilden.
Låg sterisk hinder
Det nämndes att de primära kolerna är terminala. Genom att signalera slutet på en sträcka av skelettet stör inga andra atomer rumsligt. Till exempel grupperna -CH3 de kan interagera med atomer i andra molekyler; men deras interaktioner med angränsande atomer i samma molekyl är låga. Detsamma gäller för -CHtvåOH och -CN.
Detta beror på att de praktiskt taget utsätts för "vakuum". Därför uppvisar de i allmänhet lågt steriskt hinder i förhållande till andra typer av kol (2: a, 3: e och 4: e).
Det finns dock undantag, produkten av en molekylär struktur med för många substituenter, hög flexibilitet eller en tendens att stänga in sig själv..
Reaktivitet
En av konsekvenserna av det lägre steriska hindret runt det första kolet är en större exponering för att reagera med andra molekyler. Ju färre atomer hindrar den attackerande molekylens väg mot den, desto mer sannolikt kommer dess reaktion att vara..
Men detta är sant endast ur en sterisk synvinkel. Den viktigaste faktorn är faktiskt den elektroniska; det vill säga vad är miljön hos nämnda kol 1 °.
Kolet intill det primära, överför en del av dess elektroniska densitet till det; och detsamma kan hända i motsatt riktning, vilket gynnar en viss typ av kemisk reaktion.
Således förklarar de steriska och elektroniska faktorerna varför det vanligtvis är det mest reaktiva. men det finns inte riktigt en global reaktivitetsregel för alla primära kol.
Typer
Primära kol saknar en inneboende klassificering. Istället klassificeras de på grundval av de grupper av atomer de tillhör eller till vilka de är bundna; Dessa är de funktionella grupperna. Och eftersom varje funktionell grupp definierar en specifik typ av organisk förening, finns det olika primära kol.
Till exempel gruppen -CHtvåOH härrör från den primära alkoholen RCHtvåÅH. Primära alkoholer består därför av 1 ° kol kopplade till hydroxylgruppen, -OH.
Nitrilgruppen, -CN eller -C≡N, kan å andra sidan endast fästas direkt till en kolatom med den enda C-CN-bindningen. Således förekomsten av sekundära nitriler (RtvåCN) eller mycket mindre tertiär (R3CN).
Ett liknande fall inträffar med substituenten härledd från amiden, -CONHtvå. Det kan genomgå substitutioner av väten i kväveatomen; men dess kol kan bara bindas till ett annat kol, och därför kommer det alltid att betraktas som primärt, C-CONHtvå.
Och med avseende på -CH-gruppen3, Det är ett alkylsubstitut som bara kan binda till ett annat kol och därför vara primärt. Om etylgruppen beaktas, -CHtvåCH3, det kommer omedelbart att märkas att CHtvå, metylengrupp, är ett 2 ° kol eftersom det är kopplat till två kol (C-CHtvåCH3).
Exempel
Aldehyder och karboxylsyror
Några exempel på primära kol har nämnts. Förutom dem finns följande par grupper: -CHO och -COOH, kallad formyl respektive karboxyl. Kolen i dessa två grupper är primära, eftersom de alltid kommer att bilda föreningar med formlerna RCHO (aldehyder) och RCOOH (karboxylsyror).
Detta par är nära besläktat med varandra på grund av oxidationsreaktionerna som formylgruppen genomgår för att omvandlas till karboxyl:
RCHO => RCOOH
Reaktion som lider av aldehyder eller -CHO-gruppen om den är som en substituent i en molekyl.
I linjära aminer
Klassificeringen av aminer beror uteslutande på substitutionsgraden av väten i -NH-gruppentvå. I linjära aminer kan dock primära kol observeras, som i propanamin:
CH3-CHtvå-CHtvå-NHtvå
Observera att CH3 det kommer alltid att vara ett första kol, men den här gången CHtvå till höger är också 1 ° eftersom den är bunden till ett enda kol och NH-gruppentvå.
I alkylhalogenider
Ett exempel som mycket liknar det föregående ges med alkylhalogeniderna (och i många andra organiska föreningar). Antag att bromopropan:
CH3-CHtvå-CHtvå-Br
I det förblir de primära kolerna desamma.
Avslutningsvis överskrider 1 ° -kolerna typen av organisk förening (och till och med organometallisk), eftersom de kan finnas i någon av dem och identifieras helt enkelt för att de är kopplade till ett enda kol.
Referenser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10th utgåva.). Wiley plus.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Morrison, R. T. och Boyd, R. N. (1987). Organisk kemi. (5ta Utgåva). Ledare Addison-Wesley Interamericana.
- Ashenhurst J. (16 juni 2010). Primär, sekundär, tertiär, kvartär i organisk kemi. Master organisk kemi. Återställd från: masterorganicchemistry.com
- Wikipedia. (2019). Primärt kol. Återställd från: en.wikipedia.org



Ingen har kommenterat den här artikeln än.