
Kiselkarbidkemisk struktur, egenskaper och användningar

De Kiselkarbid Det är ett kovalent fast ämne som består av kol och kisel. Den har stor hårdhet med ett värde på 9,0 till 10 på Mohs-skalan, och dess kemiska formel är SiC, vilket kan antyda att kol är bundet till kisel genom en kovalent trippelbindning, med en positiv laddning (+) på Si och en negativ laddning (-) på kol (+Ja≡C-).
Egentligen är obligationerna i denna förening helt olika. Det upptäcktes 1824 av den svenska kemisten Jön Jacob Berzelius när han försökte syntetisera diamanter. 1893 upptäckte den franska forskaren Henry Moissani ett mineral vars sammansättning innehöll kiselkarbid.

Denna upptäckt gjordes när man undersökte bergprover från en meteorits krater i Devil's Canyon, USA. Han kallade detta mineral moissanit. Å andra sidan skapade Edward Goodrich Acheson (1894) en metod för att syntetisera kiselkarbid, reagera sand eller kvarts med hög renhet med petroleumkoks..
Goodrich utsåg den erhållna produkten carborundum (eller carborundium) och grundade ett företag för att producera slipmedel.
Artikelindex
- 1 Kemisk struktur
- 2 fastigheter
- 2.1 Allmänna egenskaper
- 2.2 Termiska egenskaper
- 2.3 Mekaniska egenskaper
- 2.4 Elektriska egenskaper
- 3 användningsområden
- 3.1 Som ett slipmedel
- 3.2 I form av strukturerad keramik
- 3.3 Andra användningsområden
- 4 Referenser
Kemisk struktur
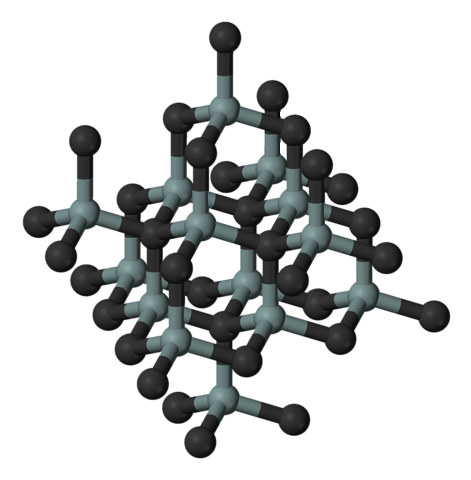
Bilden ovan illustrerar den kubiska och kristallina strukturen hos kiselkarbid. Detta arrangemang är detsamma som för diamant, trots skillnaderna i atomradier mellan C och Si..
Alla bindningar är starkt kovalenta och riktade, till skillnad från joniska fasta ämnen och deras elektrostatiska interaktioner.
SiC bildar molekylär tetraedra; det vill säga alla atomer är bundna till fyra andra. Dessa tetraedriska enheter är sammanfogade av kovalenta bindningar och antar skiktade kristallstrukturer..
Dessa skikt har också sina egna kristallarrangemang, som är av tre typer: A, B och C.
Det vill säga ett lager A skiljer sig från B och det senare från C. Således består SiC-kristallen av stapling av en sekvens av lager, fenomenet känt som polytypism förekommer..
Till exempel består den kubiska polytypen (liknande den hos diamant) av en stapel ABC-lager och har därför en 3C kristallin struktur..
Andra staplar av dessa lager genererar också andra strukturer mellan dessa rombohedrala och sexkantiga polytyper. I själva verket blir de kristallina strukturerna av SiC en "kristallin störning".
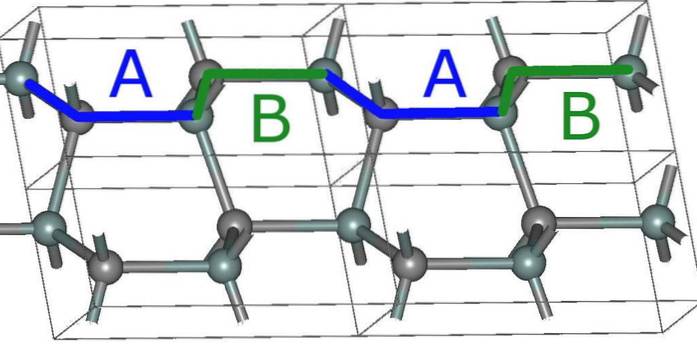
Den enklaste sexkantiga strukturen för SiC, 2H (övre bilden), bildas som ett resultat av staplingen av lagren med ABABA-sekvensen ... Efter vartannat lager upprepas sekvensen, och det är där siffran 2 kommer ifrån.
Egenskaper
Generella egenskaper
Molmassa
40,11 g / mol
Utseende
Det varierar beroende på hur man erhåller och vilka material som används. Det kan vara: gula, gröna, svartblå eller skimrande kristaller.
Densitet
3,16 g / cm3
Smältpunkt
2830 ºC.
Brytningsindex
2,55.
Kristaller
Det finns polymorfism: αSiC sexkantiga kristaller och βSiC kubiska kristaller.
Hårdhet
9 till 10 på Mohs-skalan.
Motståndskraft mot kemiska medel
Det är motståndskraftigt mot verkan av starka syror och alkalier. Dessutom är kiselkarbid kemiskt inert..
Termiska egenskaper
- Hög värmeledningsförmåga.
- Tål höga temperaturer.
- Hög värmeledningsförmåga.
- Låg koefficient för linjär termisk expansion, så den tål höga temperaturer med låg expansion.
- Motståndskraftig mot termisk chock.
Mekaniska egenskaper
- Hög motståndskraft mot kompression.
- Motståndskraftig mot nötning och korrosion.
- Det är ett lätt material med stor styrka och motstånd.
- Bibehåller sin elastiska motståndskraft vid höga temperaturer.
Egenskaper elektrisk
Det är en halvledare som kan utföra sina funktioner vid höga temperaturer och extrema spänningar, med liten avledning av sin kraft till det elektriska fältet..
Applikationer
Som ett slipmedel
- Kiselkarbid är en halvledare som tål höga temperaturer, högspänningsgradienter eller elektriska fält åtta gånger mer än vad kisel tål. Av denna anledning är det användbart vid konstruktion av dioder, transitorer, dämpare och mikroenheter med hög energi..
- Ljusdioder (LED) och detektorer för de första radioapparaterna (1907) tillverkades med föreningen. För närvarande har kiselkarbid ersatts vid tillverkning av LED-lampor med galliumnitrid, som avger 10 till 100 gånger ljusare ljus.
- I elektriska system används kiselkarbid som blixtstång i elkraftsystem, eftersom de kan reglera dess motstånd genom att reglera spänningen över den..
I form av strukturerad keramik
- I en process som kallas sintring upphettas kiselkarbidpartiklarna - liksom de av följeslagarna - till en temperatur som är lägre än smälttemperaturen för denna blandning. Således ökar det motståndet och styrkan hos det keramiska föremålet genom bildandet av starka bindningar mellan partiklarna..
- Strukturkeramik av kiselkarbid har haft ett brett spektrum av applikationer. De används i skivbromsar och motorfordonskopplingar, i dieselpartikelfilter och som tillsats i oljor för att minska friktionen.
- Användningen av kiselkarbidkonstruktionskeramik har blivit utbredd i delar som utsätts för höga temperaturer. Till exempel är detta fallet med raketinjektorns hals och ugnsrullarna..
- Kombinationen av hög värmeledningsförmåga, seghet och hög temperaturstabilitet gör komponenter för värmeväxlarrör tillverkade av kiselkarbid..
- Strukturell keramik används i sandblästringsinsprutare, fordonsvattenpumpstätningar, lager och extruderingsformar. Det är också materialet för deglar som används vid smältning av metall..
- Det är en del av värmeelementen som används vid smältning av glas och icke-järnmetaller samt vid värmebehandling av metaller.
Andra användningsområden
- Den kan användas vid mätning av gasernas temperatur. I en teknik som kallas pyrometri upphettas ett kiselkarbidfilament och avger strålning som korrelerar med temperaturen i området 800-2500 ºK..
- Det används i kärnkraftverk för att förhindra läckage av material som produceras genom klyvning.
- Vid tillverkning av stål används det som bränsle.
Referenser
- Nicholas G. Wright, Alton B. Horsfall. Silicon Carbide: The Return of an Old Friend. Material Matters Volume 4 Article 2. Hämtad den 5 maj 2018 från: sigmaaldrich.com
- John Faithfull. (Februari 2010). Carborundum kristaller. Hämtad den 5 maj 2018 från: commons.wikimedia.org
- Charles & Colvard. Polytypism och Moissanite. Hämtad den 5 maj 2018 från: moissaniteitalia.com
- Materialvetare. (2014). SiC2Hstruktur A. [Figur]. Hämtad den 5 maj 2018 från: commons.wikimedia.org
- Wikipedia. (2018). Kiselkarbid. Hämtad den 5 maj 2018 från: en.wikipedia.org
- Navarro SiC. (2018). Kiselkarbid. Hämtad den 5 maj 2018 från: navarrosic.com
- University of Barcelona. Kiselkarbid, SiC. Hämtad den 5 maj 2018 från: ub.edu
- CarboSystem. (2018). Kiselkarbid. Hämtad den 5 maj 2018 från: carbosystem.com



Ingen har kommenterat den här artikeln än.