
Komponenter för elektrokemiska celler, hur de fungerar, typer, exempel
De elektrokemiska celler De är anordningar där kemiska reaktioner äger rum där kemisk energi omvandlas till elektrisk energi eller vice versa. Dessa celler utgör hjärtat av elektrokemi, själen är det potentiella utbytet av elektroner som kan uppstå, spontant eller inte, mellan två kemiska arter..
En av de två arterna oxiderar, förlorar elektroner, medan den andra reduceras och får de överförda elektronerna. Vanligtvis är arten som reduceras en metallkatjon i lösning, som genom att få elektroner hamnar elektriskt på en elektrod gjord av samma metall. Å andra sidan är arten som oxiderar en metall som förvandlas till metallkatjoner.
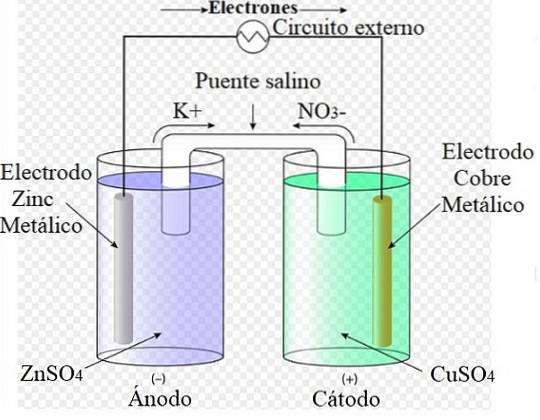
Till exempel representerar bilden ovan Daniels cell: den enklaste av alla elektrokemiska celler. Den metalliska zinkelektroden oxiderar och frigör Zn-katjonertvå+ till det vattenhaltiga mediet. Detta inträffar i ZnSO-behållaren4 till vänster.
Till höger, lösningen som innehåller CuSO4 reduceras, vilket omvandlar katjonerna Cutvå+ i metallisk koppar som avsätts på kopparelektroden. Under utvecklingen av denna reaktion färdas elektronerna genom en extern krets som aktiverar dess mekanismer; och därför tillhandahålla elektrisk energi för driften av ett team.
Artikelindex
- 1 Komponenter i elektrokemiska celler
- 1.1 Elektroder
- 1.2 Upplösning av elektrolyter
- 1.3 Saltbro
- 2 Typer av elektrokemiska celler och hur de fungerar
- 2.1 Galvanisk
- 2.2 Elektrolytik
- 3 Exempel
- 3.1 Daniels cell
- 3.2 Platina och väteceller
- 3.3 Downs cell
- 4 Referenser
Elektrokemiska cellkomponenter
Elektroder
Elektriska strömmar genereras eller konsumeras i elektrokemiska celler. För att säkerställa ett tillräckligt flöde av elektroner måste det finnas material som är bra ledare av elektricitet. Det är här elektroderna och den externa kretsen kommer in, försedda med koppar-, silver- eller guldkablar..
Elektroderna är materialen som ger ytan där reaktionerna kommer att äga rum i de elektrokemiska cellerna. Det finns två typer enligt reaktionen som förekommer i dem:
-Anod, elektrod där oxidation sker
-Katod, elektrod där reduktion sker
Elektroderna kan vara gjorda av ett reagerande material, som i fallet med Daniels cell (zink och koppar); eller ett inert material, såsom när de är gjorda av platina eller grafit.
Elektronerna som frigörs av anoden måste nå katoden; men inte genom en lösning, utan genom en metallkabel som förbinder båda elektroderna med en extern krets.
Elektrolytupplösning
Lösningen som omger elektroderna spelar också en viktig roll, eftersom den är berikad med starka elektrolyter. såsom: KCl, KNO3, NaCl, etc. Dessa joner gynnar till viss del migrationen av elektroner från anoden till katoden, liksom deras ledning genom elektrodernas närhet för att interagera med den art som ska reduceras..
Havsvatten leder till exempel elektricitet mycket bättre än destillerat vatten med en lägre jonkoncentration. Det är därför elektrokemiska celler har en upplösning av starka elektrolyter bland sina komponenter..
Saltlösning bro
Jonerna i lösningen börjar omge elektroderna och orsakar en polarisering av laddningarna. Lösningen runt katoden börjar bli negativt laddad, eftersom katjonerna minskar; när det gäller Daniels cell, Cu-katjonernatvå+ genom att deponera som metallisk koppar på katoden. Således börjar det finnas ett underskott av positiva laddningar.
Det är här saltbryggan ingriper för att balansera laddningarna och förhindra att elektroderna polariseras. Mot katodens sida eller fack kommer katjoner att migrera från saltbryggan, antingen K+ eller Zntvå+, att ersätta Cutvå+ förbrukad. Under tiden kommer inga anjoner att migrera från saltbryggan3- mot anodfacket, för att neutralisera den ökande koncentrationen av Zn-katjonertvå+.
Saltbryggan består av en mättad lösning av salter, med ändarna täckta av en gel som är permeabel för joner, men ogenomtränglig för vatten..
Elektrokemiska celltyper och hur de fungerar
Hur en elektrokemisk cell fungerar beror på vilken typ det är. Det finns i princip två typer: galvanisk (eller voltaisk) och elektrolytisk.
Galvanisk
Daniels cell är ett exempel på en galvanisk elektrokemisk cell. I dem inträffar reaktionerna spontant och batteriets potential är positiv; ju högre potential, desto mer el kommer cellen att leverera.
Celler eller batterier är exakt galvaniska celler: den kemiska potentialen mellan de två elektroderna omvandlas till elektrisk energi när en extern krets ingriper som förbinder dem. Således migrerar elektronerna från anoden, antänder utrustningen som batteriet är anslutet till och returneras direkt till katoden.
Elektrolytisk
Elektrolytiska celler är de vars reaktioner inte sker spontant, såvida de inte får elektrisk energi från en extern källa. Här uppstår det motsatta fenomenet: elektricitet tillåter att icke-spontana kemiska reaktioner utvecklas.
En av de mest kända och mest värdefulla reaktionerna som sker inom denna typ av cell är elektrolys..
Laddningsbara batterier är exempel på elektrolytiska och samtidigt galvaniska celler: de laddas för att vända sina kemiska reaktioner och återställa de initiala förhållandena som ska återanvändas..
Exempel
Daniels cell
Följande kemiska ekvation motsvarar reaktionen i Daniels cell där zink och koppar deltar:
Zn (s) + Cutvå+(aq) → Zntvå+(aq) + Cu (s)
Men Cu-katjonernatvå+ och Zntvå+ de är inte ensamma utan åtföljs av anjonerna SÅ4två-. Denna cell kan representeras enligt följande:
Zn | ZnSO4 | | KURS4 | Cu
Daniels cell kan byggas i vilket laboratorium som helst, vilket är mycket återkommande som en praxis vid införandet av elektrokemi. Som Cutvå+ deponeras som Cu, den blå färgen på CuSO-lösningen4 kommer att förloras.
Platin vätecell
Tänk dig en cell som förbrukar vätgas, producerar metalliskt silver och samtidigt levererar elektricitet. Detta är platina- och vätecellen, och dess allmänna reaktion är som följer:
2AgCl (s) + Htvå(g) → 2Ag (s) + 2H+ + 2Cl-
Här i anodfacket har vi en inert platinaelektrod, nedsänkt i vatten och i vilken vätgas pumpas. Htvå oxiderar till H+ och ger sina elektroner till den mjölkiga AgCl-fällningen i katodfacket med en metallisk silverelektrod. På detta silver minskar AgCl och elektrodens massa ökar..
Denna cell kan representeras som:
Pt, Htvå | H+ | | Cl-, AgCl | Ag
Downs cell
Och slutligen, bland de elektrolytiska cellerna har vi den smälta natriumkloridcellen, bättre känd som Downs-cellen. Här används el så att en volym av smält NaCl passerar genom elektroderna, vilket orsakar följande reaktioner i dem:
2Na+(l) + 2e- → 2Na (s) (katod)
2Cl-(l) → Cltvå(g) + 2e- (anod)
2NaCl (l) → 2Na (s) + Cltvå(g) (global reaktion)
Tack vare el och natriumklorid kan sålunda metalliskt natrium och klorgas framställas..
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Wikipedia. (2020). Elektrokemisk cell. Återställd från: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (29 januari 2020). Elektrokemiska celler. Återställd från: thoughtco.com
- R. Ship. (s.f.). Elektrokemiska celler. Återställd från: hyperphysics.phy-astr.gsu.edu
- Chemicool. (2017). Definition av elektrokemisk cell. Återställd från: chemicool.com
- Patricia Jankowski. (2020). Vad är en elektrokemisk cell? - Struktur och användningsområden. Studie. Återställd från: study.com
- Alkemi (3 mars 2011). Elektrokemiska celler. Kemi och vetenskap. Återställd från: laquimicaylaciencia.blogspot.com

Ingen har kommenterat den här artikeln än.