
Ättiksyra historia, struktur, egenskaper, användningsområden
De ättiksyra eller etansyra är en färglös organisk vätska vars kemiska formel är CH3COOH. Vid upplösning i vatten erhålls en välkänd blandning som kallas vinäger, som har använts som tillsats i livsmedel under lång tid. Vinäger är en vattenlösning av ättiksyra med en koncentration på cirka 5%.
Som namnet antyder är det en syraförening och därför har ättika pH-värden lägre än 7. I närvaro av dess acetatsalt utgör det ett buffert-system som är effektivt för att reglera pH mellan 2,76 och 6,76; det vill säga det håller pH inom detta intervall med måttliga tillsatser av en bas eller en syra.

Dess formel räcker för att inse att den bildas genom förening av en metylgrupp (CH3och en karboxylgrupp (COOH). Efter myrsyra, HCOOH, är en av de enklaste organiska syrorna; vilket också representerar slutpunkten för många jäsningsprocesser.
Således kan ättiksyra framställas genom aerob och anaerob bakteriell fermentering och genom kemisk syntes, varvid metanolkarbonyleringsprocessen är den huvudsakliga mekanismen för dess produktion..
Förutom daglig användning som salladsdressing representerar den i industrin råvaran för produktion av cellulosaacetat, en polymer som används för att göra fotografiska filmer. Dessutom används ättiksyra vid syntes av polyvinylacetat, som används för att göra ett lim för trä..
När ättika har blivit mycket koncentrerad kallas den inte längre som sådan och kallas isättika. Vid dessa koncentrationer, även om det är en svag syra, är den mycket frätande och kan orsaka hud- och andningsirritation bara genom grund andning. Isättika finner användning som lösningsmedel i organiska synteser.
Artikelindex
- 1 Historia
- 1.1 1800
- 1.2 1900
- 2 Strukturen av ättiksyra
- 3 Fysikaliska och kemiska egenskaper
- 3.1 Kemiska namn
- 3.2 Molekylformel
- 3.3 Fysiskt utseende
- 3.4 Lukt
- 3.5 Smak
- 3.6 Kokpunkt
- 3.7 Smältpunkt
- 3.8 Flampunkt
- 3.9 Löslighet i vatten
- 3.10 Löslighet i organiska lösningsmedel
- 3.11 Densitet
- 3.12 Ångdensitet
- 3.13 Ångtryck
- 3.14 Sönderfall
- 3.15 Viskositet
- 3.16 Korrosivitet
- 3.17 Förbränningsvärme
- 3.18 Förångningsvärme
- 3,19 pH
- 3.20 Ytspänning
- 3,21 pKa
- 3.22 Kemiska reaktioner
- 4 Produktion
- 4.1 Oxidativ eller aerob jäsning
- 4.2 Anaerob jäsning
- 4.3 Karbonylering av metanol
- 4.4 Oxidation av acetaldehyd
- 5 användningsområden
- 5.1 Industriell
- 5.2 Som lösningsmedel
- 5.3 Läkare
- 5.4 I mat
- 6 Referenser
Berättelse
Mannen som tillhör många kulturer har använt jäsning av många frukter, baljväxter, flingor etc. för att erhålla alkoholhaltiga drycker, en produkt av omvandlingen av socker, såsom glukos, till etanol,3CHtvåÅh.
Förmodligen för att den ursprungliga metoden för produktion av alkohol och vinäger är jäsning, kanske försök att producera alkohol på obestämd tid, för många århundraden sedan, erhölls vinäger av misstag. Notera likheten mellan de kemiska formlerna för ättiksyra och etanol.
Redan under 300-talet f.Kr. beskrev den grekiska filosofen Theophastus vinägernas verkan på metaller för produktion av pigment, såsom blyvit.
1800
1823 designades en tornformad utrustning i Tyskland för aerob jäsning av olika produkter för att få ättiksyra i form av ättika..
1846 uppnådde Herman Foelbe först syntesen av ättiksyra genom användning av oorganiska föreningar. Syntesen började med kloreringen av koldisulfid och avslutades, efter två reaktioner, med en elektrolytisk reduktion till ättiksyra.
I slutet av 1800-talet och början av 1900-talet, på grund av J. Weizmanns forskning, började bakterien Clostridium acetobutylicum användas för produktion av ättiksyra genom anaerob fermentering..
1900
I början av 1900-talet var den dominerande tekniken produktion av ättiksyra genom oxidation av acetaldehyd.
År 1925 designade Henry Dreyfus från det brittiska företaget Celanese en pilotanläggning för karbonylering av metanol. Senare, 1963, introducerade det tyska företaget BASF användningen av kobolt som katalysator.
Otto Hromatka och Heinrich Ebner (1949) designade en tank med ett omrörningssystem och lufttillförsel för aerob jäsning, avsedd för produktion av vinäger. Detta redskap, med vissa anpassningar, används fortfarande.
1970 använde det nordamerikanska företaget Montsanto ett katalysatorsystem baserat på rodium för karbonylering av metanol..
Därefter introducerade BP-företaget 1990 Cativa-processen med användning av iridiumkatalysatorn för samma ändamål. Denna metod visade sig vara effektivare och mindre miljövänlig än Montsanto-metoden..
Struktur av ättiksyra
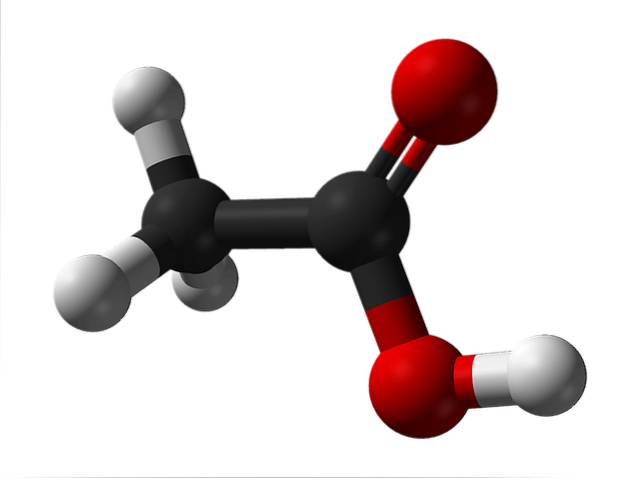
Den övre bilden visar strukturen hos ättiksyra representerad med en sfär- och stapelmodell. De röda sfärerna motsvarar syreatomerna, som i sin tur tillhör karboxylgruppen, -COOH. Därför är det en karboxylsyra. På höger sida av strukturen är metylgruppen, -CH3.
Som man kan se är det en mycket liten och enkel molekyl. Den presenterar ett permanent dipolmoment på grund av -COOH-gruppen, vilket också gör det möjligt för ättiksyra att bilda två vätebindningar i följd.
Det är dessa broar som orienterar CH-molekylerna rumsligt.3COOH för att bilda dimerer i flytande (och gasformigt) tillstånd.

Ovan i bilden kan du se hur de två molekylerna är ordnade för att bilda de två vätebindningarna: O-H-O och O-H-O. För att avdunsta ättiksyra måste tillräckligt med energi tillföras för att bryta dessa interaktioner; anledning till att det är en vätska med en kokpunkt högre än den för vatten (ungefär 118 ° C).
Fysiska och kemiska egenskaper
Kemiska namn
Syra:
-Ättiksyra
-Etanoisk
-Etyl
Molekylär formel
CtvåH4ELLERtvå eller CH3COOH.
Fysiskt utseende
Färglös vätska.
Odör
Karaktäristisk tunnland.
Smak
Brinnande.
Kokpunkt
244ºF till 760mmHg (117.9ºC).
Smältpunkt
61,6 ºF (16,6 ºC).
antändningspunkt
112ºF (öppen kopp) 104ºF (sluten kopp).
Vattenlöslighet
106 mg / ml vid 25 ºC (det är blandbart i alla proportioner).
Löslighet i organiska lösningsmedel
Det är lösligt i etanol, etyleter, aceton och bensen. Det är också lösligt i koltetraklorid.
Densitet
1,051 g / cm3 vid 1.044 g / cm3 vid 25 ° C).
Ång-densitet
2,07 (relativt luft = 1).
Ångtryck
15,7 mmHg vid 25 ºC.
Sönderfall
Vid uppvärmning över 440 ° C sönderdelas den för att producera koldioxid och metan.
Viskositet
1 056 mPascal vid 25 ºC.
Korrosivitet
Isättika är mycket frätande och dess intag kan orsaka allvarliga lesioner i matstrupen och pyloren hos människa..
Förbränningsvärme
874,2 kJ / mol.
Förångningsvärme
23,70 kJ / mol vid 117,9 ° C.
23,36 kJ / mol vid 25,0 ºC.
pH
-En lösning med 1 M koncentration har ett pH på 2,4
- För en 0,1 M lösning är dess pH 2,9
- Och 3.4 om lösningen är 0.01M
Ytspänning
27,10 mN / m vid 25 ºC.
pKa
4,76 vid 25 ° C.
Kemiska reaktioner
Ättiksyra är frätande för många metaller och frigör H-gastvå och bildar metallsalter som kallas acetater. Med undantag för krom (II) acetat är acetater lösliga i vatten. Dess reaktion med magnesium representeras av följande kemiska ekvation:
Mg (s) + 2 CH3COOH (ag) => (CH3KUTTRA)tvåMg (ag) + Htvå (g)
Genom reduktion bildar ättiksyra etanol. Det kan också bilda ättiksyraanhydrid från förlusten av vatten från två vattenmolekyler..
Produktion
Som tidigare nämnts producerar jäsning ättiksyra. Denna jäsning kan vara aerob (i närvaro av syre) eller anaerob (utan syre).
Oxidativ eller aerob jäsning
Bakterier av släktet Acetobacter kan verka på etanol eller etylalkohol och orsaka dess oxidation till ättiksyra i form av ättika. Med denna metod kan vinäger med en koncentration av 20% ättiksyra framställas..
Dessa bakterier kan producera vinäger, som verkar på en mängd olika insatsvaror som inkluderar olika frukter, fermenterade baljväxter, malt, spannmål såsom ris eller andra grönsaker som innehåller eller kan producera etylalkohol..
Den kemiska reaktionen som underlättas av bakterier av släktet Acetobacter är som följer:
CH3CHtvåOH + Otvå => CH3COOH + HtvåELLER
Oxidativ jäsning utförs i tankar med mekanisk omröring och syretillförsel..
Anaerob jäsning
Det är baserat på förmågan hos vissa bakterier att producera ättiksyra genom att verka direkt på sockerarter utan att kräva mellanliggande ämnen för produktion av ättiksyra..
C6H12ELLER6 => 3CH3COOH
Bakterien som ingriper i denna process är Clostridium acetobutylicum, som kan ingripa i syntesen av andra föreningar, förutom ättiksyra..
Acetogena bakterier kan producera ättiksyra, som verkar på molekyler som består av endast en kolatom; sådant är fallet med metanol och kolmonoxid.
Anaerob jäsning är billigare än oxidativ jäsning, men det har begränsningen att bakterier av släktet Clostridium inte är särskilt resistenta mot surhet. Detta begränsar dess förmåga att producera vinäger med en hög koncentration av ättiksyra, såsom uppnås vid oxidativ jäsning..
Karbonylering av metanol
Metanol kan reagera med kolmonoxid för att producera ättiksyra i närvaro av katalysatorer
CH3OH + CO => CH3COOH
Med jodmetan som katalysator sker karbonyleringen av metanol i tre steg:
I ett första steg reagerar hydrojodsyra (HI) med metanol och producerar jodometan, som reagerar i ett andra steg med kolmonoxid och bildar föreningen jodacetaldehyd (CH2).3COI). Därefter CH3COI hydratiserar för att producera ättiksyra och regenerera HI.
Monsanto-processen (1966) är en metod för tillverkning av ättiksyra genom katalytisk karbonylering av metanol. Den utvecklas vid ett tryck på 30 till 60 atm, vid en temperatur på 150 - 200 ºC och med hjälp av ett rodiumkatalysatorsystem..
Monsanto-processen ersattes till stor del av Cativa (1990) -processen som utvecklats av BP Chemicals LTD, som använder en iridiumkatalysator. Denna process är billigare och mindre förorenande.
Acetaldehydoxidation
Denna oxidation kräver metalliska katalysatorer såsom naftenater, mangansalter, kobolt eller krom..
2 CH3CHO + Otvå => 2 CH3COOH
Acetaldehydoxidation kan ha ett mycket högt utbyte som kan nå 95% med lämpliga katalysatorer. Biprodukterna från reaktionen separeras från ättiksyra genom destillation.
Efter metoden för karbonylering av metanol är oxidationen av acetaldehyd den andra formen i procent av industriproduktionen av ättiksyra.
Applikationer
Industriell
-Ättiksyra reagerar med eten i närvaro av syre för att bilda vinylacetatmonomer med användning av palladium som reaktionskatalysator. Vinylacetat polymeriserar till polyvinylacetat, som används som en komponent i färger och vidhäftande material..
-Reagerar med olika alkoholer för att producera estrar, inklusive etylacetat och propylacetat. Acetatestrar används som lösningsmedel för bläck, nitrocellulosa, beläggningar, lacker och akryllacker..
-Genom kondensation av två molekyler ättiksyra, förlorar en molekyl av en molekyl, ättiksyraanhydrid, CH3CO-O-COCH3. Denna förening är involverad i syntesen av cellulosaacetat, en polymer som utgör ett syntetiskt tyg och används vid framställning av fotografiska filmer..
Som lösningsmedel
-Det är ett polärt lösningsmedel med förmågan att bilda vätebindningar. Det kan lösa polära föreningar såsom oorganiska salter och sockerarter, men det löser också opolära föreningar såsom oljor och fetter. Dessutom är ättiksyra blandbar med polära och opolära lösningsmedel..
-Blandningen av ättiksyra i alkaner beror på förlängningen av kedjan av dessa: när längden på kedjan av alkaner ökar minskar dess blandbarhet med ättiksyra.
Läkare
-Utspädd ättiksyra används som ett antiseptiskt medel, appliceras topiskt, med förmågan att attackera bakterier som streptokocker, stafylokocker och pseudomonas. På grund av denna åtgärd används den vid behandling av hudinfektioner.
-Ättiksyra används vid endoskopi av Barrett-matstrupen. Detta är ett tillstånd där matstrupen i matstrupen ändras och liknar slemhinnan i tunntarmen..
-En 3% ättiksyragel verkar vara ett effektivt komplement till behandling med det vaginala läkemedlet Misoprostol, vilket inducerar medicinsk abort i mitten av trimestern, särskilt hos kvinnor med ett vaginalt pH på 5 eller mer..
-Det används som en ersättning för kemisk skalning. Emellertid har komplikationer uppstått med denna användning, eftersom minst ett fall av brännskador som en patient har rapporterats har rapporterats.
I mat
Vinäger har använts som kryddor och smakämnen i livsmedel under lång tid, vilket gör detta till den mest kända applikationen av ättiksyra..
Referenser
- Byju's. (2018). Vad är etansyra? Återställd från: byjus.com
- PubChem. (2018). Ättiksyra. Återställd från: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Ättiksyra. Återställd från: en.wikipedia.org
- Kemikaliebok. (2017). Isättika. Återställd från: chemicalbook.com
- Ättiksyra: vad är det och vad är det för? Återhämtad från: acidoacetico.info
- Helmenstine, Anne Marie, Ph.D. (22 juni 2018). Vad är isättika? Återställd från: thoughtco.com


Ingen har kommenterat den här artikeln än.