
Borsyras kemiska struktur, egenskaper, beredning, användningsområden
De borsyra är en oorganisk förening vars kemiska formel är H3BO3. Den består av ett vitt eller färglöst fast ämne. Det är en svag syra som i vattenlösning, beroende på dess koncentration, producerar ett pH mellan 3,8 och 4,8. Det är dåligt lösligt i kallt vatten och måttligt lösligt i varmt vatten..
Borsyra upptäcktes 1702 av Wilhelm Homberg (1652-1713), som behandlade borax med svavelsyra och fick en lösning med medicinsk verkan som fick namnet Hombergs lugnande vatten..

Det påpekas dock också att Homberg beredde borsyran genom att tillsätta vatten till boraxen och värma upp lösningen tills den avdunstade, vilket lämnade borsyrakristallerna i sedimentet..
Denna syra är en mycket användbar förening som har många tillämpningar inom industri och medicin, som också används som insektsmedel, träskydd, brandskyddsmedel och är en beståndsdel i en pH-buffertlösning..
Artikelindex
- 1 Kemisk struktur
- 1.1 Kristaller
- 2 fastigheter
- 2.1 Namn
- 2.2 Molmassa
- 2.3 Fysiskt utseende
- 2.4 Lukt
- 2.5 Smak
- 2.6 Smältpunkt
- 2.7 Kokpunkt
- 2.8 Löslighet i vatten
- 2.9 Löslighet i andra lösningsmedel
- 2.10 Fördelningskoefficient oktanol / vatten
- 2.11 Surhet (pKa)
- 2,12 pH
- 2.13 Ångtryck
- 2.14 Stabilitet
- 2.15 Sönderfall
- 2.16 Reaktivitet
- 3 Förberedelse
- 4 användningsområden
- 4.1 Inom industrin
- 4.2 I medicin
- 4.3 Insektsmedel
- 4.4 Bevarande
- 4,5 pH-buffert
- 4.6 Kärnreaktorer
- 4.7 Jordbruk
- 5 Kontraindikationer
- 6 Referenser
Kemisk struktur
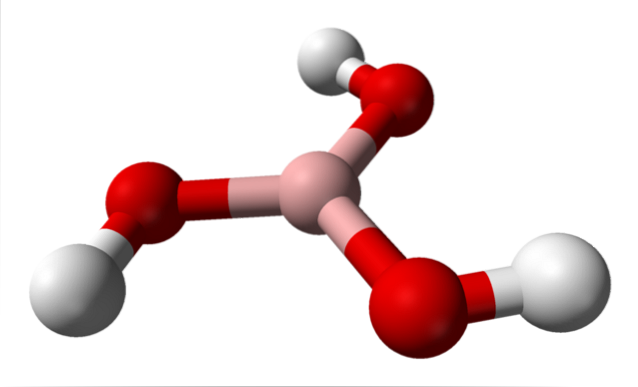
I den övre bilden har vi själva molekylen av H3BO3. Observera att väteatomer, representerade av vita sfärer, inte är bundna till den centrala boratomen, som den kemiska formeln antyder; utan snarare till syreatomer, representerade av röda sfärer.
Således är en mer bekväm, även om den mindre används, formel för borsyra B (OH)3, vilket indikerar att dess surhet beror på H-joner+ släpptes från deras OH-grupper. Molekylen B (OH)3 har en trigonal plangeometri, med sin boratom som har en kemisk hybridisering sptvå.
B (OH)3 Det är en mycket kovalent molekyl, eftersom elektronegativitetsskillnaden mellan boratomen och syret inte är särskilt stor; så B-O-bindningarna är väsentligen kovalenta. Observera också att strukturen för denna molekyl liknar en spinner. Kan den rotera på sin egen axel på samma sätt?
Kristaller
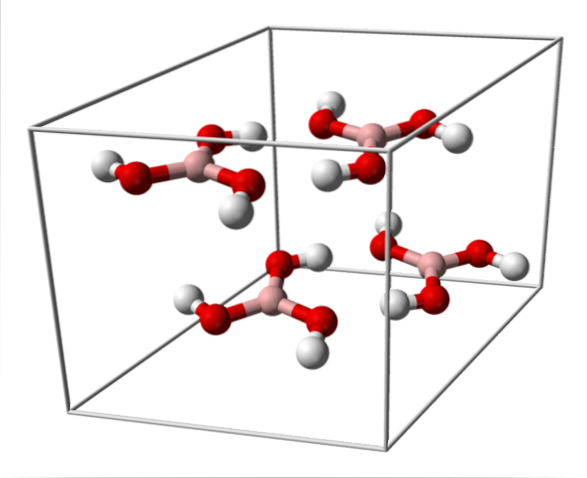
Den övre bilden visar enhetscellen som motsvarar triklinisk kristallstruktur för borsyra som under vissa syntesförhållanden kan anta den kompakta sexkantiga strukturen. Observera att det finns fyra molekyler per enhetscell och att de är ordnade i två lager, A och B, alternerande (de läggs inte ovanpå varandra).
På grund av symmetrin och orienteringen av B-OH-bindningarna kan det antas att B (OH)3 är apolar; dock förekomsten av intermolekylära vätebindningar förändrar historien. Varje molekyl av B (OH)3 att ge eller ta emot tre av dessa broar, med totalt sex dipol-dipolinteraktioner, som observerats i bilden nedan:
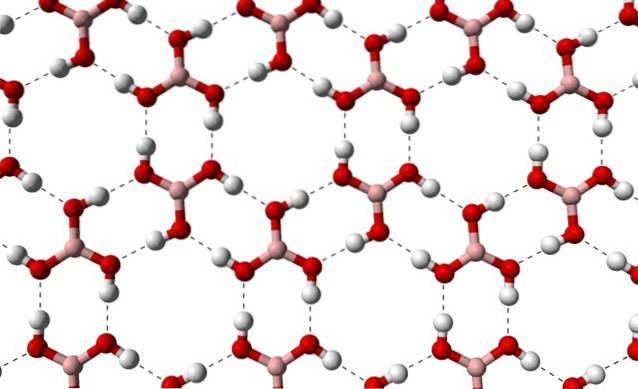
Observera att dessa vätebindningar är riktade interaktioner som styr borsyrakristaller och skapar mönster för prydnadsaspekter; inre ringar kanske med tillräckligt med utrymme för att täppa till några föroreningar som inte finns i kristalldefekterna.
Dessa vätebindningar, trots den låga molekylmassan av B (OH)3, de håller sitt glas sammanhängande nog att det behöver en temperatur på 171 ºC för att smälta. Det är okänt vilka effekter högt tryck (i storleksordningen GPa) skulle ha på molekylskikten av B (OH)3.
Egenskaper
Namn
IUPAC: borsyra och bortrihydrooxid. Andra namn: ortoborsyra, boracinsyra, sassolit, borofax och trihydroxiboran.
Molmassa
61,83 g / mol
Fysiskt utseende
Klar, färglös, kristallin vit fast substans. Det finns också som granulat eller som ett vitt pulver. Något krämig vid beröring.
Odör
Toalett
Smak
Något bitter
Smältpunkt
170,9 ºC
Kokpunkt
300 ºC
Vattenlöslighet
Måttligt lösligt i kallt vatten och lösligt i varmt vatten:
2,52 g / 100 ml (0 ºC)
27,50 g / 100 ml (100 ºC)
Borsyra är delvis löslig i vatten och tenderar att sjunka i den. Denna löslighet tenderar att öka i närvaro av syror, såsom saltsyra, citronsyra och vinsyra..
Löslighet i andra lösningsmedel
-Glycerol: 17,5% vid 25 ºC
-Etylenglykol: 18,5% vid 25 ºC
-Aceton: 0,6% vid 25 ºC
-Etylacetat: 1,5% vid 25 ºC
-Metanol: 172 g / L vid 25 ºC
-Etanol: 94,4 g / L vid 25 ºC
Fördelningskoefficient oktanol / vatten
Logg P = -0,29
Surhet (pKa)
9.24. 12.4. 13.3. Dessa är de tre konstanterna i deras respektive dissociationer för att frigöra H+ i vatten.
pH
3,8 - 4,8 (3,3% i vattenlösning)
5,1 (0,1 molar)
Ångtryck
1,6 10-6 mmHg
Stabilitet
Stabil i vatten
Sönderfall
Den sönderdelas vid uppvärmning över 100 ° C och bildar borsyraanhydrid och vatten.
Reaktivitet
Borsyra bildar lösliga salter med monovalenta katjoner, till exempel: NatvåB4ELLER7.10HtvåO och olösliga salter med tvåvärda katjoner, CaB4ELLER7.6HtvåELLER.
I vattenlösning producerar den en sur lösning, med tanke på att denna egenskap berodde på subtraktion av OH-grupper- av vattnet. Borsyra klassificeras som en svag syra av Lewis-typen.
Borsyra reagerar med glycerol och mannitol, vilket ökar surheten i det vattenhaltiga mediet. PKa modifieras från 9,2 till 5 på grund av bildandet av bor-mannitolchelat [BC6H8ELLERtvå(ÅH)två]-, som släpper H+.
Förberedelse
Borsyra finns i ett fritt tillstånd i vulkanutstrålningar i regioner som Toscana i Italien, Lipariöarna och i delstaten Nevada, USA. Det finns också i mineraler som borax, boracit, ulexit och colemanite..
Borsyra framställs huvudsakligen genom reaktion av mineralet borax (natriumtetraboratdekahydrat) med mineralsyror, såsom saltsyra, svavelsyra, etc..
NatvåB4ELLER910HtvåO + HCl => 4 H3BO3 + 2 NaCl + 5HtvåELLER
Det framställs också genom hydrolys av bortrihalogenid och diboran..
Borsyra framställs av kolemanit (CatvåB6ELLERelva6 HtvåELLER). Förfarandet består i att behandla mineralet med svavelsyra för att lösa borföreningarna.
Därefter separeras lösningen där borsyra finns från de olösta fragmenten. Lösningen behandlas med vätesulfid för att fälla ut arsenik- och järnföroreningarna. Supernatanten kyls för att producera en borsyrautfällning och separera den från suspensionen..
Applikationer
Inom industrin
Borsyra används vid tillverkning av glasfiber. Genom att bidra till att minska smältpunkten ökar det styrkan och effektiviteten hos textilfiberglas: ett material som används för att förstärka plasten som används i fartyg, industriella rör och datorkretskort..
Borsyra deltar i tillverkningen av borosilikatglas, vilket gör det möjligt att få ett glas som är resistent mot temperaturförändringar, som kan användas i hemmets kök, i glasvaror i laboratorier, lysrör, fiberoptik, LCD-skärmar etc..
Den används inom metallindustrin för att härda och behandla stållegeringar, samt för att främja metallbeläggningen av material.
Den används som en kemisk komponent vid hydraulisk sprickbildning (fracking): en metod som används vid olje- och gasutvinning. Borsyra fungerar som ett brandskyddsmedel i cellulosa, plast och textilmaterial som är impregnerade med borsyra för att öka deras motståndskraft mot eld..
Inom medicin
Borsyra används utspädd i ögontvätt. Borsyragelatinkapslar används för att behandla svampinfektioner, särskilt Candida albicans. Det har också använts vid behandling av akne.
Borsyra strömmas på strumpor för att förhindra fotinfektioner, såsom fotsvamp. På samma sätt används lösningar som innehåller borsyra vid behandling av extern otit hos människor såväl som hos djur..
Borsyra tillsätts till flaskorna som används för urinuppsamling, vilket förhindrar bakteriell kontaminering innan de undersöks i diagnostiska laboratorier..
Insekticid
Borsyra används för att kontrollera spridningen av insekter, såsom kackerlackor, termiter, myror etc. Det dödar inte omedelbart kackerlackor, eftersom det först påverkar matsmältnings- och nervsystemet, förutom att förstöra deras exoskelett.
Borsyra utövar sin verkan långsamt, så att insekter som har intagit den kommer i kontakt med andra insekter och sprider därmed förgiftning..
Bevarande
Borsyra används för att förhindra angrepp av trä av svampar och insekter, och används för detta ändamål i kombination med etylenglykol. Denna behandling är också effektiv vid bekämpning av silt och alger..
PH-buffert
Borsyra och dess konjugatbas bildar ett buffersystem med pKa = 9,24, vilket indikerar att denna buffert är mest effektiv vid alkaliskt pH, vilket inte är vanligt hos levande varelser. Boratbuffert används dock vid reglering av pH i simbassänger..
Kärnreaktorer
Borsyra har förmågan att fånga termiska neutroner, vilket minskar risken för okontrollerad kärnklyvning som kan leda till kärnkraftsolyckor..
jordbruk
Bor är ett väsentligt element för växttillväxt, vilket ledde till användning av borsyra för att elementet skulle bidra. Men för mycket borsyra kan skada växter, särskilt citrusfrukter..
Kontraindikationer
Användning av borsyra på denuduerad hud, sår eller brännprodukt som möjliggör dess absorption bör undvikas. Detta är en giftig förening inuti kroppen och i vissa fall kan den orsaka svimning, kramper, spasmer, ansikts tics och lågt blodtryck..
Läkaren bör konsulteras för användning av borsyra vaginalkapslar hos gravida kvinnor, eftersom det har visats att det kan orsaka fosterdeformationer och en minskning av barnets kroppsvikt vid födseln..
Placering av borsyra, som används som insektsmedel, på platser inom barns räckhåll bör också undvikas, eftersom barn har en större känslighet för den toxiska effekten av borsyra och fastställer den dödliga dosen i dem till 2000 till 3000 mg..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Borsyra. Återställd från: en.wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Borsyra. PubChem-databas. CID = 7628. Återställd från: pubchem.ncbi.nlm.nih.gov
- Redaktörerna för Encyclopaedia Britannica. (28 mars 2019). Borsyra. Encyclopædia Britannica. Återställd från: britannica.com
- Hållare Vibrerande. (9 november 2018). De dolda användningarna av borsyra i ditt dagliga liv. Återställd från: carriervibrating.com
- Nationellt bekämpningsmedelsinformationscenter. (s.f.). Borsyra. Återställd från: npic.orst.edu
- Utarbetande. (30 november 2017). Borsyra: egenskaper och användningar av denna kemiska förening. Återställd från: acidos.info
- Kloridnatrium. (2019). Borsyra. Återställd från: chlorurosodio.com
- Spanish Society of Hospital Pharmacy. (s.f.). Borsyra. [PDF]. Återställd från: workgroups.sefh.es



Ingen har kommenterat den här artikeln än.