
Kristallina fasta strukturer, egenskaper, typer, exempel

De kristallina fasta ämnen De är de vars mikroskopiska strukturer är ordnade och följer ett distinkt mönster för ett givet kristallgitter; till exempel: bland annat kubik, sexkantig, triklinik, rombohedral.
Dessa fasta ämnen sägs existera som kristaller, som visar fasetter och geometriska mönster som speglar hur ordnade de är inuti. Andra exempel på kristallina fasta ämnen är diamant, kvarts, antracen, torris, kaliumklorid eller magnesiumoxid..

Ett välkänt par kristallina fasta ämnen är socker och salt (NaCl). Vid första anblicken visar båda vita kristaller; men deras egenskaper skiljer sig enormt. Socker är ett molekylärt kristallint fast ämne, medan salt är ett joniskt kristallint fast ämne. Den första består av sackarosmolekyler; och den andra av Na-joner+ och Cl-.
Bilden ovan ger en glimt av hur ljusa sockerkristaller kan vara. Saltkristallerna är dock inte långt efter. Även om socker och salt verkar som bröder, är deras strukturer olika: socker, som är sackaros, har en monoklinisk struktur; medan salt, en kubisk struktur.
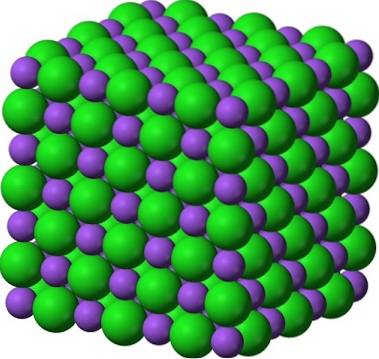
Pulveriserat socker och salt (glasyr) förblir kristallint; dess kristaller har bara blivit så mycket mindre för våra ögon. Kristalliniteten hos ett fastämne definieras därför mer av dess inre struktur än av dess yttre utseende eller dess ljusstyrka..
Artikelindex
- 1 Struktur av kristallina fasta ämnen
- 2 fastigheter
- 3 typer av kristallina fasta ämnen
- 3.1 Jonisk
- 3.2 Metallisk
- 3.3 Molekylär
- 3.4 Kovalenta nätverk
- 4 Exempel
- 4.1 Jonisk
- 4.2 Metallisk
- 4.3 Molekylär
- 4.4 Kovalenta nätverk
- 5 Referenser
Struktur av kristallina fasta ämnen
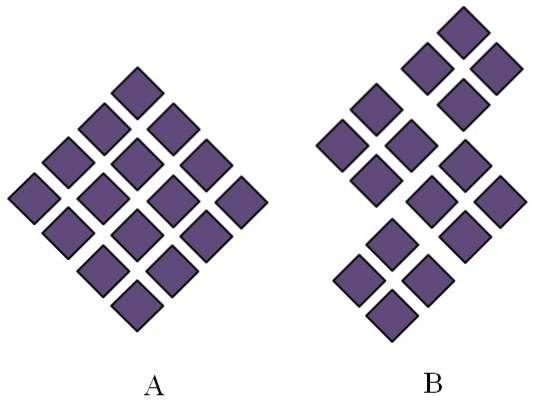
Kristallina fasta ämnen har ordnade strukturer. Deras geometriska egenskaper beror på vilken typ av kristallgitter de tillhör, vilket i sin tur projiceras externt i formen av kristallen (kristallint system). Bilden ovan illustrerar två viktiga begrepp i sådana strukturer: periodicitet och kristallkorn..
Den rumsliga ordningen av partiklarna i ett kristallint fast ämne är periodisk; det vill säga det upprepar sig om och om igen i alla riktningar. Detta skapar sitt eget strukturella mönster för varje fast och kristallgitter; till exempel, det är här salt och socker börjar skilja sig utöver deras kemiska natur.
I A arrangeras romberna för att ge upphov till en rombe av större proportioner. Varje lila romb representerar en partikel eller en uppsättning partiklar (atomer, joner eller molekyler). Således kan en makroskopisk kristall av A förväntas ha ett rombohedralt utseende..
Under tiden är romberna i B ordnade på ett sådant sätt att de ger upphov till kristallkorn; dessa är mycket små kristaller (kristalliter). B sägs då vara ett polykristallint fast ämne; det vill säga den bildas genom agglomerering av flera kristalliter.
Sammanfattningsvis kan ett fast ämne helt enkelt vara kristallint (A) eller polykristallint (B); A bildar kristaller, medan B-polykristaller.
Egenskaper
Egenskaperna hos kristallina fasta ämnen beror på deras typ av kristall. Det är redan känt att deras strukturer är ordnade och att de också tenderar att presentera ljusa egenskaper som mineralälskare blir kär i. Det nämndes emellertid att ett pulverformigt fast ämne, även "av", också kan klassificeras som kristallint..
Det sätt på vilket deras partiklar är rumsligt orienterade gör att de kan ha några viktiga egenskaper för sin karaktärisering. Till exempel kan kristallina fasta ämnen diffraktion av röntgenstrålar, vilket skapar diffraktionsspektra från vilka den mikroskopiska strukturen hos en kristall kan bestämmas..
Eftersom strukturen är periodisk diffunderar också värmen på samma sätt genom det fasta ämnet; så länge det inte finns några orenheter inblandade. Således är smältpunkterna för ett kristallint fast ämne konstanta och varierar inte oavsett hur de mäts..
Typer av kristallina fasta ämnen
Typerna av kristallina fasta ämnen är baserade på vilken typ av partiklar de är gjorda av och vad deras interaktioner eller bindningar är. Det finns i huvudsak fyra typer: joniska, metalliska, molekylära och kovalenta nätverk.
Även när de uppvisar en viss grad av orenheter, fortsätter de att vara kristallina, även om deras egenskaper påverkas och de inte visar samma värden som förväntas för ett rent fast ämne..
Jonik
Salt är ett exempel på ett joniskt kristallint fast ämne, eftersom det består av Na-joner+ och Cl-. Därför reglerar jonbindningen i denna typ av fasta ämnen: det är de elektrostatiska krafterna som styr den strukturella ordningen..
Metallisk
Alla metallatomer bildar metallkristaller. Detta innebär att till exempel en silvergaffel är ett konglomerat av smält silverkristaller. Den inre eller mikroskopiska strukturen är densamma i varje föremåls spännvidd och förblir oförändrad från gaffelhandtaget till spetsen på tänderna..
Molekyl
Socker är ett exempel på ett molekylärt kristallint fast ämne, eftersom det består av sackarosmolekyler. Därför består denna typ av fast ämne av molekyler, som genom sina intermolekylära interaktioner (och inte kovalenta bindningar) lyckas skapa en ordnad struktur..
Kovalenta nätverk
Slutligen har vi de kristallina fasta ämnena i kovalenta nätverk. Kovalenta bindningar dominerar i dem, eftersom de är ansvariga för att upprätta en ordning och hålla atomerna starkt fixerade i sina respektive rumsliga positioner. Vi talar inte om joner, atomer eller molekyler utan om tredimensionella nätverk.
Exempel
Därefter och slutligen kommer några exempel att nämnas för var och en av typerna av kristallina fasta ämnen.
Jonik
Alla salter är joniska fasta ämnen. På samma sätt finns det sulfider, hydroxider, oxider, halider och andra föreningar som också består av joner, eller deras interaktioner är väsentligen joniska. Så vi har:
-KCl
-Fall4
-Ba (OH)två
-KURS4
-FeCl3
-NatvåS
-MgO
-CaFtvå
-NaHCO3
-(NH4)tvåCrO4
Förutom dessa exempel anses den stora majoriteten av mineraler vara joniska kristallina fasta ämnen.
Metallisk
Varje metallelement förekommer naturligt som metallkristaller. Några av dem är:
-Koppar
-Järn
-Aluminium
-Krom
-Metalliskt väte (under ofattbara tryck)
-Volfram
-Zirkonium
-Titan
-Magnesium
-Natrium
Molekyl
Det finns en mängd olika molekylära kristallina fasta ämnen. Praktiskt taget alla organiska föreningar som stelnar kan skapa kristaller om dess renhet är hög eller om dess struktur inte är för invecklad. Så vi har:
-Is (HtvåELLER)
-Torris (COtvå)
-Jagtvå
-P4
-S8 (och dess polymorfer)
-Antracen
-Fast syre
-Fast ammoniak
-Fenolftalein
-Bensoesyra
Kovalenta nätverk
Och slutligen, bland några kristallina fasta ämnen i kovalenta nätverk har vi:
-Diamant
-Grafit
-Kolnanorör
-Fullerenes
-Kvarts
-Kisel
-Germanium
-Bornitrid
Från denna lista kan kolnanorör och fullerener också betraktas som molekylära kristallina fasta ämnen. Detta beror på att även om de består av kovalent bundna kolatomer definierar de enheter som kan visualiseras som makromolekyler (fotbollar och rör)..
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2020). Kristall. Återställd från: en.wikipedia.org
- Kemi LibreTexts. (16 juni 2019). Kristallina och amorfa fasta ämnen. Återställd från: chem.libretexts.org
- Rachel Bernstein & Anthony Carpi. (2020). Egenskaper hos fasta ämnen. Återställd från: visionlearning.com

Ingen har kommenterat den här artikeln än.