
Svavelsyras struktur, egenskaper, nomenklatur och användningsområden
De svavelsyra är en av de många svaveloxosyrorna, vars kemiska formel är HtvåStvåELLER7. Formeln säger uttryckligen att det finns två svavelatomer, och som dess namn också anger måste det finnas två molekyler av HtvåSW4 bara en; dock finns det sju oxygener istället för åtta, så ett svavel måste ha tre.
Denna syra anses vara en av huvudkomponenterna i oleum (eller rökande svavelsyra), som är en "tät" form av svavelsyra. Sådan är dess övervägande, att vissa anser oleum som en synonym för svavelsyra; vilket också är känt under det traditionella namnet pyrosulfuric acid.

Bilden visar en behållare med oleum, med en koncentration av svaveltrioxid, SO3, vid 20%. Denna substans kännetecknas av att den är oljig och färglös; även om den kan bli gulaktig eller brun beroende på koncentrationen av SO3 och förekomsten av vissa orenheter.
Ovanstående avser deltagande av SO3 i HtvåStvåELLER7; det vill säga en molekyl av HtvåSW4 reagera med en SO3 för att bilda svavelsyra. Detta är fallet då, HtvåStvåELLER7 kan också skrivas som HtvåSW4· SW3.
Artikelindex
- 1 Struktur av svavelsyra
- 2 fastigheter
- 2.1 Sockeruttorkningsreaktion
- 3 Nomenklatur
- 4 användningsområden
- 4.1 Lagrar svavelsyra
- 4.2 Syntes av 100% svavelsyra
- 4.3 Sulfonering
- 5 Referenser
Struktur av svavelsyra
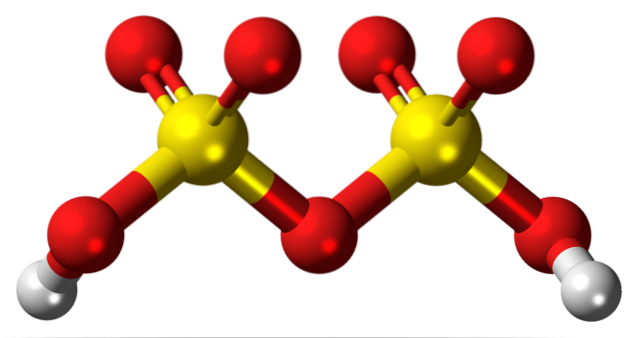
Ovan är strukturen för HtvåStvåELLER7 i en modell av sfärer och stänger. Notera vid första anblicken molekylens symmetri: den vänstra sidan av syrebroen är identisk med den högra. Ur det perspektivet kan strukturen beskrivas med formeln HO3SÅ SÅ3H.
I båda ändarna finns varje hydroxylgrupp, vars väte genom induktiv effekt av alla dessa syreatomer ökar sin positiva partiladdning; och följaktligen har svavelsyra en ännu starkare surhet än svavelsyra.
Molekylen kan skrivas som HtvåSW4· SW3. Detta hänvisar emellertid mer till en komposition av oleum än till en molekyls struktur..
Men om en vattenmolekyl tillsätts till HtvåStvåELLER7, två molekyler av H kommer att frigörastvåSW4:
HtvåStvåELLER7 + HtvåELLER <=> 2HtvåSW4
Jämvikten kan förskjutas åt vänster: till bildandet av H.tvåStvåELLER7 från HtvåSW4 om det tillförs värme. Det är av den anledningen som vid HtvåStvåELLER7 det är också känt som pyrosvavelsyra; eftersom den kan alstras efter upphettning av svavelsyra.
Som nämnts i början, HtvåStvåELLER7 bildas av den direkta kombinationen av HtvåSW4 Och så3:
SW3 + HtvåSW4 <=> HtvåStvåELLER7
Egenskaper
Egenskaperna hos svavelsyra är inte särskilt väl definierade, eftersom det är extremt svårt att isolera rent från oleum.
Man bör komma ihåg att i oleum kan det finnas andra föreningar med formlerna HtvåSW4XSO3, där beroende på värdet på x kan du till och med ha polymera strukturer.
Ett sätt att visualisera det är att föreställa sig att den övre strukturen av H.tvåStvåELLER7 blir mer långsträckt av fler enheter av SO3 och syrebroar.
I nästan rent tillstånd består den av ett instabilt (fumande) kristallint fast ämne som smälter vid 36 ° C. Denna smältpunkt kan emellertid variera beroende på den verkliga kompositionen..
Svavelsyra kan bilda så kallade disulfatsalter (eller pyrosulfat). Om det till exempel reagerar med kaliumhydroxid bildar det kaliumpyrosulfat, KtvåStvåELLER7.
Dessutom kan det kommenteras att den har en molekylvikt av 178 g / mol och två syraekvivalenter (2H-joner+ som kan neutraliseras med en stark bas).
Sockeruttorkningsreaktion
Med denna förening i form av oleum kan en märklig reaktion utföras: omvandlingen av sockerbitar till kolblock.
HtvåStvåELLER7 reagerar med sockerarter som eliminerar alla deras OH-grupper i form av vatten, vilket gynnar nya bindningar mellan kolatomer; leder som orsakar svart kol.
Nomenklatur
Svavelsyra anses vara anhydrid av svavelsyra; det vill säga den förlorar en vattenmolekyl som ett resultat av kondensationen mellan två syramolekyler. Med tanke på så många möjliga namn för denna förening rekommenderar IUPAC-nomenklaturen helt enkelt svavelsyra..
Uttrycket "pyro" hänför sig uteslutande till det som bildas som en produkt av appliceringen av värme. IUPAC rekommenderar inte detta namn för HtvåStvåELLER7; men det används fortfarande idag av många kemister.
-Ico-slutet förblir oförändrat eftersom svavelatomen fortsätter att upprätthålla en valens på +6. Det kan till exempel beräknas med följande aritmetiska operation:
2H + 2S + 7O = 0
2 (+1) + 2S + 7 (-2) = 0
S = 6
Applikationer
Lagrar svavelsyra
Svavelsyra, med tanke på att den stelnar som oleum, kan lösa upp och lagra svavelsyra på ett säkrare sätt. Detta beror på att operativsystemet3 undviker att skapa en obandbar "dimma", som är mycket mer löslig i HtvåSW4 än i vatten. För att få HtvåSW4, det skulle räcka att tillsätta vatten till oleum:
HtvåStvåELLER7 + HtvåELLER <=> 2HtvåSW4
100% svavelsyrasyntes
Från ovanstående ekvation, HtvåSW4 den späds i tillsatt vatten. Till exempel om du har en vattenlösning av HtvåSW4, där SO3 Det tenderar att fly och representerar en risk för arbetare. När olja tillsätts till lösningen reagerar det med vattnet och bildar mer svavelsyra. det vill säga öka din koncentration.
Om lite vatten finns kvar tillsätts mer SO3, som reagerar med HtvåSW4 för att producera mer svavelsyra eller oleum, och sedan återhydratiseras detta genom att "torka" HtvåSW4. Processen upprepas tillräckligt många gånger för att erhålla svavelsyra i en koncentration av 100%.
En liknande process används för att erhålla 100% salpetersyra. På samma sätt har det använts för att uttorka andra kemiska ämnen, som används för att tillverka sprängämnen..
Sulfonering
Det används för att sulfonera strukturer, såsom de av färgämnen; det vill säga lägga till -SO-grupper3H, som genom att förlora sitt sura proton kan förankra sig i textilfiberns polymer.
Å andra sidan används oleums surhet för att uppnå den andra nitreringen (tillsätt -NO-gruppertvå) till aromatiska ringar.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2018). Svavelsyra. Återställd från: en.wikipedia.org
- PubChem. (2019). Pyrosvavelsyra. Återställd från: pubchem.ncbi.nlm.nih.gov
- Seong Kyu Kim, Han Myoung Lee och Kwang S. Kim. (2015). Svavelsyra dissocierad av två vattenmolekyler: ab initio och densitet funktionell teori beräkningar. Phys. Chem. Chem. Phys., 2015, 17, 28556
- Contra Costa Health Services. (s.f.). Oleum / svaveltrioxid: kemiskt faktablad. [PDF]. Återställd från: cchealth.org


Ingen har kommenterat den här artikeln än.