
Väte selenid (H2Se) struktur, egenskaper och användningsområden

De väteselen eller väteselenid är en oorganisk förening vars kemiska formel är HtvåJag vet. Den är kovalent till sin natur och under vanliga temperatur- och tryckförhållanden är den en färglös gas; men med en stark lukt som känns igen av dess mindre närvaro. Kemiskt är det en kalkogenid, så selen har en valens på -2 (Setvå-).
Av alla seleniderna är HtvåDet är det mest giftiga eftersom dess molekyl är liten och dess selenatom har mindre steriskt hinder när man reagerar. Å andra sidan tillåter dess lukt dem som arbetar med det att upptäcka det på plats i händelse av läckage utanför laboratoriekåpan..
Väteselenid kan syntetiseras genom den direkta kombinationen av dess två element: molekylärt väte, Htvå, och metalliskt selen. Det kan också erhållas genom att lösa selenrika föreningar, såsom järn (II) selenid, FeSe, i saltsyra..
Å andra sidan framställes väte-selenid genom att lösa väte-selenid i vatten; det vill säga den första löses i vatten, medan den andra består av gasformiga molekyler.
Dess huvudsakliga användning är att vara en källa till selen i organisk och oorganisk syntes.
Artikelindex
- 1 Struktur av väteselenid
- 2 fastigheter
- 2.1 Fysiskt utseende
- 2.2 Molekylär massa
- 2.3 Kokpunkt
- 2.4 Smältpunkt
- 2.5 Ångtryck
- 2.6 Densitet
- 2,7 pKa
- 2.8 Löslighet i vatten
- 2.9 Löslighet i andra lösningsmedel
- 3 Nomenklatur
- 3.1 Selenid eller hydrid?
- 4 användningsområden
- 4.1 Metabolisk
- 4.2 Industriell
- 5 Referenser
Struktur av väteselenid
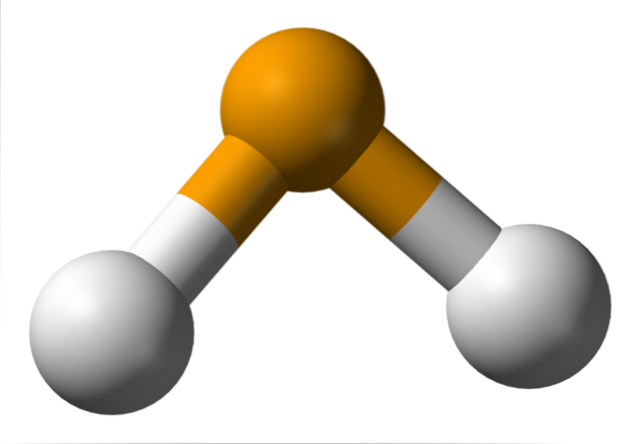
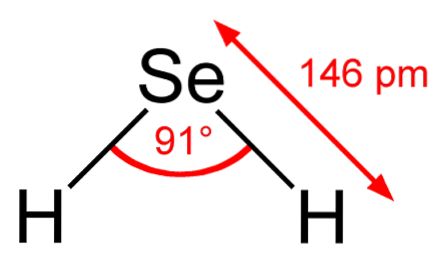
I den övre bilden observeras att molekylen av HtvåDen har en vinkelgeometri, även om dess vinkel på 91 ° gör att den ser mer ut som en L än en V. I denna modell av sfärer och stavar är väteatomerna och selenatomerna vita respektive gula sfärer..
Denna molekyl, som visas, är den i gasfasen; det vill säga för väteselenid. När det är löst i vatten släpper det ut en proton och i lösning har vi paret HSe- H3ELLER+; detta par joner kommer till väteselenid, betecknad som HtvåSe (ac) för att skilja den från väteselenid, HtvåSe (g).
Därför är strukturerna mellan HtvåSe (ac) och HtvåSe (g) är mycket olika; den första omges av en vattenhaltig sfär och uppvisar jonladdningar, och den andra består av ett agglomerat av molekyler i gasfasen.
Molekyler av HtvåDe kan knappt interagera med varandra genom mycket svaga dipol-dipolkrafter. Selen, även om det är mindre elektronegativt än svavel, koncentrerar en högre elektrontäthet genom att "ta bort det" från väteatomerna..
Selenhydrid tabletter
Om molekylerna av HtvåDe utsätts för ett extraordinärt tryck (hundratals GPa), teoretiskt tvingas de stelna genom bildandet av Se-H-Se-bindningar; Dessa är bindningar av tre centra och två elektroner (3c-2e) där väte deltar. Därför börjar molekylerna bilda polymera strukturer som definierar ett fast ämne..
Under dessa förhållanden kan det fasta ämnet berikas med mer väte, vilket helt modifierar de resulterande strukturerna. Dessutom blir kompositionen typ HnSe, där n varierar från 3 till 6. Således har selenhydrider komprimerade av dessa tryck och i närvaro av väte kemiska formler H3Se till H6jag vet.
Dessa väteberikade selenhydrider uppskattas ha supraledande egenskaper.
Egenskaper
Fysiskt utseende
Färglös gas som vid låga temperaturer luktar som ruttna rädisor och ruttna ägg om koncentrationen ökar. Dess lukt är värre och mer intensiv än vätesulfid (som redan är ganska obehaglig). Detta är dock bra eftersom det hjälper till att det enkelt detekteras och minskar riskerna för långvarig kontakt eller inandning..
När den brinner avger den en blåaktig flamprodukt av de elektroniska interaktionerna i selenatomerna.
Molekylär massa
80,98 g / mol.
Kokpunkt
-41 ° C.
Smältpunkt
-66 ° C.
Ångtryck
9,5 atm vid 21 ° C.
Densitet
3553 g / 1.
pKtill
3,89.
Vattenlöslighet
0,70 g / 100 ml. Detta bekräftar det faktum att H-selenatomentvåKan inte bilda märkbara vätebindningar med vattenmolekyler.
Löslighet i andra lösningsmedel
-Löslig i CStvå, vilket inte är förvånande på grund av den kemiska analogin mellan selen och svavel.
-Lösligt i fosgen (vid låga temperaturer, eftersom det kokar vid 8 ° C).
Nomenklatur
Som redan förklarats i tidigare avsnitt varierar namnet på denna förening beroende på om HtvåDet är i gasfas eller löst i vatten. När det är i vatten kallas det väteselenid, vilket är inget annat än en hydrat i oorganiska termer. Till skillnad från gasformiga molekyler är dess sura karaktär större.
Oavsett om det är en gas eller upplöst i vatten bibehåller selenatomen samma elektroniska egenskaper; till exempel är dess valens -2, såvida den inte genomgår en oxidationsreaktion. Denna valens på -2 är anledningen till att den kallas seleniuroxe väte, eftersom seleniden är Setvå-; som är mer reaktivt och reducerande än Stvå-, sulfid.
Om systematisk nomenklatur används måste antalet väteatomer i föreningen specificeras. Således har HtvåDet kallas: selenid av gavväte.
Selenid eller hydrid?
Vissa källor hänvisar till det som en hydrid. Om det verkligen var, skulle selen ha en positiv laddning på +2 och väte skulle ha en negativ laddning på -1: SeHtvå (Jag vettvå+, H-). Selen är en mer elektronegativ atom än väte och hamnar därför på den högsta elektrontätheten i H-molekylentvåjag vet.
Däremot kan existensen av selenhydrid inte teoretiskt uteslutas. Faktum är att närvaron av anjonerna H- Det skulle underlätta Se-H-Se-obligationerna, ansvariga för de solida strukturerna som bildades vid enorma tryck enligt beräkningsstudier.
Applikationer
Metabolisk
Även om det verkar motstridigt, trots den stora toxiciteten hos HtvåDet produceras i kroppen i den metaboliska vägen för selen. Så snart det produceras använder celler det emellertid som mellanprodukt vid syntes av selenoproteiner, eller så blir det metylerat och utsöndras; ett av symtomen på detta är smaken av vitlök i munnen.
Industriell
HtvåDen används huvudsakligen för att tillsätta selenatomer till fasta strukturer, såsom halvledarmaterial; till organiska molekyler, såsom alkener och nitriler för syntes av organiska selenider; eller till en lösning för att fälla ut metallselenider.
Referenser
- Wikipedia. (2018). Väteselenid. Återställd från: en.wikipedia.org
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Atomik. (2012). Väteselenid, HtvåJag vet. Återställd från: selenium.atomistry.com
- Tang Y. & kol. (2017). Väteselenid (HtvåSe) Dopantgas för selenimplantation. 21: a internationella konferensen om Ion Implantation Technology (IIT). Tainan, Taiwan.
- Kemisk formulering. (2018). Väteselenid. Återställd från: formulacionquimica.com
- PubChem. (2019). Väteselenid. Återställd från: pubchem.ncbi.nlm.nih.gov
- Zhang, S. et al. (2015). Fasdiagram och supraledning vid hög temperatur hos komprimerade selenhydrider. Sci. Rep. 5, 15433; doi: 10.1038 / srep15433.
- Acids.Info. (2019). Selenvätesyra: egenskaper och tillämpningar av denna hydrat. Återställd från: acidos.info/selenhidrico



Ingen har kommenterat den här artikeln än.