
Bärnstenssyrastruktur, egenskaper, produktion, användningsområden
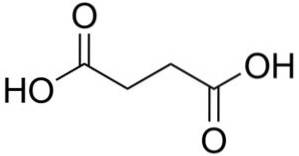
De bärnstenssyra är en fast organisk förening vars kemiska formel är C4H6ELLER4. Det är en dikarboxylsyra, det vill säga den har två karboxylgrupper -COOH, en i varje ände av molekylen vars skelett har 4 kolatomer. Det är också känt som butandisyra. Sagt att vara en alfa-, omega-dikarboxylsyra eller en C4-dikarboxylsyra.
Det distribueras i stor utsträckning i växter, svampar och djur. Dess succinatanjon är en väsentlig komponent i Krebs-cykeln, som består av en serie kemiska reaktioner som uppstår under cellulär andning..

Bärnstenssyra är en av de naturliga syrorna som finns i livsmedel, frukter som druvor och aprikoser, grönsaker som broccoli och rödbetor, ostar och kött, bland många andra..
Det finns också i gult eller succino bärnsten, från vilket dess namn kommer. Det kan erhållas genom destillation av detta eller andra hartser. Industriellt erhålls det genom hydrering av maleinsyra.
Bärnstenssyra genereras också under jäsning av vin. Dessutom är det en mycket uppskattad naturlig smakämne för olika livsmedel. Det används också som råvara för att erhålla olika kemiska föreningar som har tillämpningar i olika industriella områden, medicin och kosmetika, bland många andra..
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Kokpunkt
- 3.5 Flampunkt
- 3.6 Specifik vikt
- 3.7 Brytningsindex
- 3.8 Löslighet
- 3,9 pH
- 3.10 Dissociationskonstanter
- 3.11 Kemiska egenskaper
- 3.12 Kemiska reaktioner av industriell betydelse
- 4 Skaffa
- 5 användningsområden
- 5.1 I livsmedelsindustrin
- 5.2 Inom vinindustrin
- 5.3 Vid framställning av andra kemiska föreningar
- 5.4 I olika applikationer
- 6 Referenser
Strukturera
Bärnstenssyra har fyra kolatomer kopplade linjärt men sicksack. Det är som en butanmolekyl där metylgrupperna -CH3 är oxiderade bildande karboxylgrupper -COOH.
Nomenklatur
- Bärnstenssyra
- Butandiosyra
- 1,4-butandisyra
- 1,2-etandikarboxylsyra
- Bärnstenssyra
- Amber anda
Egenskaper
Fysiskt tillstånd
Färglösa till vita kristallina fasta, trikliniska kristaller eller monokliniska prismer
Molekylvikt
118,09 g / mol
Smältpunkt
188,0 ºC
Kokpunkt
235 ºC
Flampunkt
160 ºC (öppen koppmetod).
Specifik vikt
1,572 vid 25 ºC / 4 ºC
Brytningsindex
1450
Löslighet
I vatten: 83,2 g / L vid 25 ºC.
Löslig i etanol CH3CHtvåOH, etyleter (CH3CHtvå)tvåEller aceton CH3Bil3 och metanol CH3ÅH. Olöslig i toluen och bensen.
pH
En 0,1 molar (0,1 mol / L) vattenlösning har ett pH av 2,7.
Dissociationskonstanter
K1 = 6,4 x 10-5
Ktvå = 0,23 x 10-5
Kemiska egenskaper
Dikarboxylsyror uppvisar i allmänhet samma kemiska beteende som monokarboxylsyror. Emellertid är syrakaraktären hos en dikarboxylsyra större än den hos en monokarboxylsyra.
Beträffande joniseringen av dess väten sker jonisering av den andra karboxylgruppen mindre lätt än den för den första, vilket kan ses i dissociationskonstanterna av bärnstenssyra, där K1 är större än Ktvå.
Lös upp i vattenhaltig NaOH och NaHCO3 vattenhaltig.
Bärnstenssyra är inte hygroskopisk.
Vid uppvärmning frigör den mycket enkelt en vattenmolekyl och bildar bärnstenssyraanhydrid..
Kemiska reaktioner av industriell betydelse
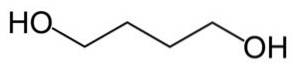
Genom reduktionsreaktion (motsatsen till oxidation) omvandlas bärnstenssyra till 1,4-butandiol.
Genom att dehydrogenera 1,4-butandiol (eliminering av väte) erhålls y-butyrolakton.
När 1,4-butandiol cykliseras (bildning av en cyklisk molekyl) erhålls tetrahydrofuran.
Genom aminering av bärnstenssyra (tillsats av en amin) erhålls pyrrolidoner.
Dess polymerisation med dioler gör det möjligt att erhålla polyestrar och med diaminer erhålles polyamider. Båda är allmänt använda polymerer.
Erhållande
Mängden som finns i naturliga källor är mycket liten, så den erhålls industriellt genom syntes från andra föreningar som i allmänhet härrör från petroleum..
Den kan framställas genom katalytisk hydrering av maleinsyra eller maleinsyraanhydrid.
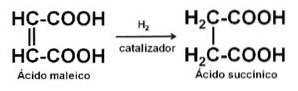
Också från fumarsyra eller från acetylen och formaldehyd.
Allt detta är emellertid petrokemiska processer som förorenar miljön och är beroende av oljepriset. Av dessa skäl har andra produktionsmetoder baserade på anaerob jäsning utvecklats under lång tid, som är billigare och mindre förorenande..
Dessa processer använder COtvå, vad som är fördelaktigt för minskningen av denna gas och den växthuseffekt som den genererar.
Dess produktion kan vara fermenterande till exempel med Anaerobiospirillum succiniproducens Y Actinobacillus succinogenes, som producerar den i höga koncentrationer från kolkällor, såsom glukos, laktos, xylos, arabinos, cellobios och andra sockerarter. De använder också COtvå som en kolkälla.
Det finns forskare som främjar utvecklingen av begreppet bioraffinaderier, vilket gör det möjligt att utnyttja den fulla potentialen för förnybara resurser. Så är fallet med användningen av avloppsvatten från tillverkning av papper, majsstammar, biomassa från alger, sockerrörsbasse, sockerrörsmelass, avfall från skördestammar och betmassa för att erhålla bärnstenssyra, bland andra produkter..

Exempelvis innefattar användningen av betmassa extraktion av pektin och den del som är rik på fenoliska antioxidanter, följt av hydrolys av cellulosa och hemicellulosa för att erhålla fermenterbara sockerarter. De senare är basen för att erhålla bärnstenssyra genom dess anaeroba jäsning i bioreaktorer..
Applikationer
I livsmedelsindustrin
Bärnstenssyra ger naturligt smak till maten. Det har en smakförbättrande effekt, så det används som tillsats i bearbetade livsmedel.
Det har föreslagits att det har effekter på smaker som inte kan dupliceras av andra syror i livsmedel, såsom den så kallade umami-smaken i vissa ostar (umami är ett japanskt ord som betyder "välsmakande").

Det används även i djurfoder för stimulering.
I vinindustrin
Bärnstenssyra förekommer naturligt under alkoholjäsning av vin. Av de icke-flyktiga syrorna som genereras i denna process motsvarar bärnstenssyra 90% av totalen..

Vin innehåller cirka 0,5 till 1,5 g / l bärnstenssyra, som kan nå 3 g / l.
Vid produktion av andra kemiska föreningar
Bärnstenssyra är råmaterialet för att erhålla produkter med högt industriellt värde såsom tetrahydrofuran, 1,4-butandiol, gamma-butyrolakton, adipinsyra, linjära alifatiska estrar, N-metylpyrrolidon och biologiskt nedbrytbara polymerer..
Dessa föreningar och material har många tillämpningar inom plastindustrin (elastiska fibrer, elastiska filmer), lim, industriella lösningsmedel (borttagning av färg och lack), rengöringsmedel inom mikroelektronik, medicin (anestetika, läkemedelsbilar), jordbruk, textilier och kosmetika..
I olika applikationer
Bärnstenssyra är en ingrediens i vissa farmaceutiska preparat. Succinimider, härledda från bärnstenssyra, används inom medicin som antikonvulsiva medel.
Det är en del av korrosionsinhibitorformler, fungerar som mjukningsmedel för polymerer och används i parfymer. Det är också en mellanprodukt i syntesen av tensider och tvättmedel.
Bärnstenssyra kan användas som en monomer för produktion av biologiskt nedbrytbara polymerer och plast.
Det används i jordbruksformler för odling av plantager.
Bärnstenssyrasalter används i fordonskylmedel och för att främja avisning, eftersom de är mindre förorenande än andra föreningar.
Succinatestrar används som tillsatser i bränslen.
Referenser
- USA National Library of Medicine. (2019). Bärnstenssyra. Återställd från: pubchem.ncbi.nlm.nih.gov
- Comuzzo, P. och Battistutta, F. (2019). Försurning och pH-kontroll i röda viner. I rödvinsteknik. Återställd från sciencedirect.com.
- Alexandri, M. et al. (2019). Omstrukturering av den konventionella sockerbetsindustrin till ett nytt bioraffinaderi: Fraktionering och bioomvandling av sockerbetsmassa till bärnstenssyra och mervärde samprodukter. ACS hållbar kemi och teknik. Februari 2019. Återställd från pubs.acs.org.
- Methven, L. (2012). Naturlig mat och dryck smakförstärkare. I naturliga livsmedelstillsatser, ingredienser och smaker. Återställd från sciencedirect.com.
- Featherstone, S. (2015). Ingredienser som används vid beredning av konserver. I en komplett kurs i konservering och relaterade processer (fjortonde upplagan). Återställd från sciencedirect.com.
- Qureshi, N. (2009). Gynnsamma biofilmer: avloppsvatten och andra industriella applikationer. I biofilmer inom livsmedels- och dryckesindustrin. Återställd från sciencedirect.com.



Ingen har kommenterat den här artikeln än.