
Kemiska kinetikfaktorer, reaktionsordning och tillämpningar
De kemisk kinetik Det är studiet av reaktionshastigheter. Dra bort experimentella eller teoretiska data om den molekylära mekanismen, genom lagar som uttrycks av matematiska ekvationer. Mekanismer består av en serie steg, varav några är snabba och andra är långsamma..
Den långsammaste av dessa kallas hastighetsbestämningssteget. Därför är det mycket kinetiskt viktigt att känna till de mellanliggande arterna och funktionsmekanismen för detta steg. En visualisering av ovanstående är att anta att reagenserna är inneslutna i en flaska och att produkterna, när de reagerar, flyr utåt.

Slutligen kommer produkterna fritt från flaskans mynning utan ytterligare kinetiska hinder. Ur detta perspektiv finns det flaskor i många storlekar och mönster. Men de har alla ett element gemensamt: en smal hals, en indikator på det avgörande steget i reaktionen..
Artikelindex
- 1 Vad studerar kemisk kinetik?
- 2 Reaktionshastighet
- 2.1 Definition
- 2.2 Allmän ekvation
- 2.3 Dessertexempel
- 2.4 Hur man bestämmer det
- 3 faktorer som påverkar reaktionshastighet
- 3.1 Arten av kemiska arter
- 3.2 Koncentration av reagenser
- 3.3 Temperatur
- 4 Reaktionsordning i kemisk kinetik
- 4.1 Nollordningsreaktioner
- 4.2 Första ordningens reaktion
- 4.3 Andra ordningens reaktion
- 4.4 Reaktionsordning mot molekyläritet
- 5 applikationer
- 6 Referenser
Vad studerar kemisk kinetik?
Experimentellt studerar denna gren av kemin koncentrationsvariationerna i en kemisk reaktion, från mätningen av en specifik egenskap.
Kemisk kinetik är den gren av kemin som ansvarar för att studera all information som kan härledas från reaktionshastigheten. Dess namn inbjuder dig att föreställa dig en fickur som markerar tid för en process, oavsett var den sker: i en reaktor, i ett moln, i en flod, i människokroppen etc..
Alla kemiska reaktioner, och därför all transformation, har termodynamiska, jämvikts- och kinetiska aspekter. Termodynamik indikerar om en reaktion är spontan eller inte; balansera dess kvantifieringsgrad; och kinetik de villkor som gynnar dess hastighet och data om dess mekanism.
Många av de väsentliga aspekterna av kemisk kinetik kan observeras i det dagliga livet: i kylen, som fryser mat för att minska nedbrytningen genom att frysa vattnet som ingår i det. Också i mognad av vinerna, vars åldring ger det sina trevliga smaker.
"Molekylernas tid" är emellertid väldigt annorlunda i sina små skalor och varierar enormt beroende på många faktorer (antal och typer av bindningar, storlekar, materietillstånd etc.).
Eftersom tid är liv, och det är också pengar, är det ytterst viktigt att veta vilka variabler som tillåter en kemisk reaktion att gå så fort som möjligt. Ibland är emellertid det motsatta önskvärt: att reaktionen sker mycket långsamt, speciellt om den är exoterm och det finns risk för explosion.
Vilka är dessa variabler? Vissa är fysiska, som vid vilket tryck eller vilken temperatur en reaktor eller ett system ska ha; och andra är kemiska, såsom typen av lösningsmedel, pH, salthalt, molekylär struktur, etc..
Innan vi hittar dessa variabler måste vi dock först studera kinetiken för den aktuella reaktionen.
Hur? Genom variationen i koncentration, som kan följas om en viss egenskap som är proportionell mot den första kvantifieras. Genom historien har metoder blivit mer sofistikerade, vilket möjliggör mer exakta och exakta mätningar och med allt kortare intervall..
Reaktionshastighet
För att bestämma hastigheten för en kemisk reaktion är det nödvändigt att veta hur koncentrationen varierar över tiden för någon av de inblandade arterna. Denna hastighet beror till stor del på många faktorer, men det viktigaste är att den är mätbar för de reaktioner som sker "långsamt".
Här är ordet "långsamt" relativt och definieras för allt som kan mätas med tillgängliga instrumentella tekniker. Om till exempel reaktionen är mycket snabbare än utrustningens mätkapacitet, kommer den inte att vara kvantitativ och dess kinetik kan inte studeras..
Därefter bestäms reaktionshastigheten vid tröskeln för någon process innan den når jämvikt. Varför? Eftersom i jämvikt är hastigheten för den framåtriktade reaktionen (produktbildning) och den för den omvända reaktionen (reaktantbildningen) densamma.
Genom att kontrollera de variabler som verkar på systemet och följaktligen dess kinetik eller reaktionshastigheten kan de ideala förhållandena väljas för att generera en viss mängd produkt på den mest önskade och säkra tiden..
Å andra sidan avslöjar denna kunskap den molekylära mekanismen, som är värdefull när man ökar utbytet av en reaktion..
Definition
Hastighet är förändringen av en storlek som en funktion av tiden. För dessa studier ligger intresset i att bestämma variationen i koncentrationen när timmar och minuter går; nano, pico eller till och med femtosekunder (10-femtons).
Du kan ha många enheter, men det enklaste och enklaste av allt är M s-1, eller vad som är lika med mol / L · s. Oavsett dess enheter bör det alltid ha ett positivt värde, eftersom det är en fysisk storlek (såsom dimensioner eller massa).
Enligt konvention har dock försvinnningshastigheterna för en reaktant ett negativt tecken, och de som ser ut för en produkt har ett positivt tecken..
Men om reaktanterna och produkterna har sina egna hastigheter, hur bestämmer man den totala reaktionshastigheten? Svaret ligger i de stökiometriska koefficienterna.
Allmän ekvation
Följande kemiska ekvation uttrycker reaktionen mellan A och B för att bilda C och D:
tillTILL + bB => cC + dD
Molära koncentrationer uttrycks vanligtvis i hakparenteser, så till exempel är koncentrationen av art A skriven som [A]. Således är reaktionshastigheten för var och en av de involverade kemiska arterna:
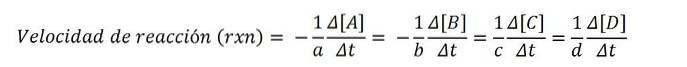
Enligt den matematiska ekvationen finns det fyra vägar för att nå reaktionshastigheten: variationen i koncentration av någon av reaktanterna (A eller B) eller av produkterna (C eller D) mäts..
Dela sedan med ett av dessa värden och dess korrekta stökiometriska koefficient med den senare och för att erhålla reaktionshastigheten rxn.
Eftersom reaktionshastigheten är en positiv kvantitet multiplicerar negativt tecken de negativa hastighetsvärdena för reaktanterna; av denna anledning koefficienterna till Y b multiplicera med (-1).
Till exempel om försvinnningshastigheten för A är - (5M / s) och dess stökiometriska koefficient till är 2, så hastigheten rxn är lika med 2,5M / s ((-1/2) x 5).
Dessert exempel

Om produkten var en efterrätt, skulle ingredienserna analogt vara reagenserna; och den kemiska ekvationen, receptet:
7Kakor + 3 brownies + 1 glass => 1 efterrätt
Och hastigheterna för var och en av de söta ingredienserna och för själva efterrätten är:
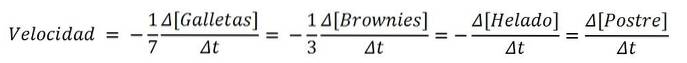
Således kan hastigheten med vilken efterrätten göras bestämmas med variationen av antingen kakorna, browniesna, glassen eller själva uppsättningen; sedan dividerar den med dess stökiometriska koefficienter (7, 3, 1 och 1). En av rutterna kan dock vara enklare än den andra..
Om du till exempel mäter hur [Dessert] stiger vid olika tidsintervall kan dessa mätningar vara svåra..
Å andra sidan kan det vara mer praktiskt och praktiskt att mäta [Cookies] på grund av deras antal eller några av deras egenskaper som gör deras koncentration lättare att bestämma än för brownies eller glass..
Hur man bestämmer det
Med tanke på den enkla reaktionen A => B, om A, till exempel, i vattenlösning, uppvisar en grön färg, beror detta på dess koncentration. Således, när A blir B, försvinner den gröna färgen, och om detta försvinnande kvantifieras kan en kurva av [A] mot t erhållas.
Å andra sidan, om B är en sur art kommer lösningens pH att sjunka till värden under 7. Således, från minskningen i pH, får vi [B] och i följd grafen [B] mot t. Sedan överlagras båda graferna kan vi se ungefär följande:

I diagrammet kan vi se hur [A] minskar med tiden, eftersom det förbrukas, och hur kurvan [B] ökar med en positiv lutning eftersom det är produkten.
Det kan också ses att [A] tenderar att vara noll (om det inte finns någon jämvikt) och att [B] når ett maximalt värde styrt av stökiometri och om reaktionen är fullständig (all A förbrukas).
Reaktionshastigheten för både A och B är tangentlinjen på någon av dessa kurvor; med andra ord derivatet.
Faktorer som påverkar reaktionshastighet
Arten av kemiska arter
Om alla kemiska reaktioner var momentana skulle deras kinetiska studier inte existera. Många har så höga hastigheter att de inte kan mätas; det vill säga de är inte mätbara.
Således är reaktionerna mellan jonerna vanligtvis mycket snabba och fullständiga (med ett utbyte cirka 100%). Å andra sidan kräver de som involverar organiska föreningar lite tid. En reaktion av den första typen är:
HtvåSW4 + 2NaOH => NatvåSW4 + 2HtvåELLER
De starka elektrostatiska interaktionerna mellan jonerna gynnar snabb bildning av vatten och natriumsulfat. Istället är en reaktion av den andra typen till exempel förestring av ättiksyra:
CH3COOH + CH3CHtvåOH => CH3COOCHtvåCH3 + HtvåELLER
Även om vatten också bildas är reaktionen inte momentan; även under gynnsamma förhållanden tar det flera timmar att slutföra.
Andra variabler har dock mer inflytande på reaktionens hastighet: koncentration av reaktanter, temperatur, tryck och närvaro av katalysatorer..
Reagenskoncentration
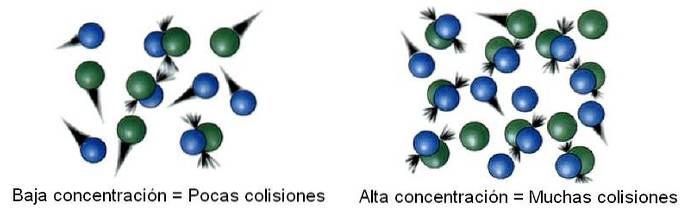
I kemisk kinetik kallas det utrymmet som studeras, skilt från oändligheten, ett system. Till exempel kan en reaktor, en bägare, en kolv, ett moln, en stjärna etc. betraktas som det system som studeras..
Således, inom systemet är molekylerna inte statiska utan snarare "färdas" till alla dess hörn. I vissa av dessa förskjutningar kolliderar den med en annan molekyl för att studsa tillbaka eller producera produkter..
Sedan är antalet kollisioner proportionellt mot koncentrationen av reaktanterna. Bilden ovan illustrerar hur systemet ändras från låga till höga koncentrationer.
Ju fler kollisioner det är, desto snabbare är reaktionshastigheten, eftersom chansen att två molekyler reagerar ökar..
Om reaktanterna är gasformiga hanteras tryckvariabeln och är relaterad till gaskoncentrationen under antagande av någon av de många existerande ekvationerna (såsom den för idealgas); eller också minskas systemets volym för att öka risken för att gasformiga molekyler kolliderar.
Temperatur
Även om antalet kollisioner ökar, har inte alla molekyler den energi som krävs för att överstiga aktiveringsenergin i processen.
Det är här temperaturen spelar en viktig roll: den utför funktionen att termiskt accelerera molekylerna så att de kolliderar med mer energi..
Således fördubblas reaktionshastigheten i allmänhet för varje 10 ° C ökning av systemtemperaturen. Men för alla reaktioner är detta inte alltid fallet. Hur förutsäger man denna ökning? Arrhenius-ekvationen svarar på frågan:
d (lnK) / dT = E / (RTtvå)
K är hastighetskonstanten vid temperaturen T, R är gaskonstanten och E är aktiveringsenergin. Denna energi är ett tecken på energibarriären som reaktanterna måste skala för att reagera..
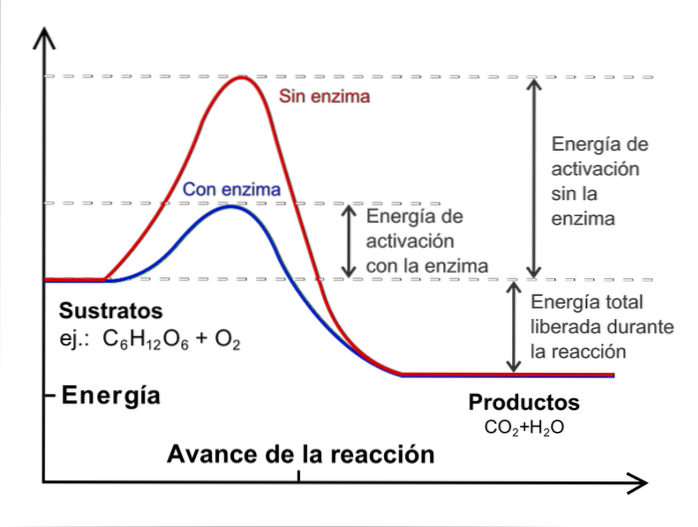
För att utföra en kinetisk studie är det nödvändigt att hålla temperaturen konstant och utan katalysatorer. Vad är katalysatorer? De är externa arter som ingriper i reaktionen men utan att konsumeras, och som minskar aktiveringsenergin.
Bilden ovan illustrerar begreppet katalys för reaktion av glukos med syre. Den röda linjen representerar aktiveringsenergin utan enzymet (biologisk katalysator), medan den med den visar den blå linjen en minskning av aktiveringsenergin.
Reaktionsordning i kemisk kinetik
I en kemisk ekvation är de stökiometriska indexen, relaterade till reaktionsmekanismen, inte lika med indexen i samma ordning. Kemiska reaktioner har vanligtvis första eller andra ordningen, sällan tredje ordningen eller högre..
För vad är det här? Eftersom kollisionerna mellan tre energiskt upphetsade molekyler är osannolika, och ännu mer fyrfaldiga eller femfaldiga kollisioner, där sannolikheten är oändlig. Fraktionerade reaktionsordrar är också möjliga. Till exempel:
NH4Cl <=>NH3 + HCl
Reaktionen är första ordningen i en mening (från vänster till höger) och andra ordning i den andra (från höger till vänster) om den anses vara en jämvikt. Medan följande jämvikt är andra ordningen i båda riktningarna:
2HI <=> Htvå + Jagtvå
Är molekyläritet och reaktionsordning densamma? Nej. Molekularitet är antalet molekyler som reagerar för att ge upphov till produkter, och den totala reaktionsordningen är samma ordning som de reaktanter som är involverade i det bestämmande hastighetssteget..
2KMnO4 + 10KI + 8HtvåSW4 => 2MnSO4 + 5Itvå + 6KtvåSW4 + 8HtvåELLER
Denna reaktion, trots att den har höga stökiometriska index (molekyläritet), är faktiskt en andra ordningens reaktion. Med andra ord är det avgörande steget för hastigheten av andra ordningen.
Nollordningsreaktioner
De förekommer i fallet med heterogena reaktioner. Till exempel: mellan en vätska och ett fast ämne. Således är hastigheten oberoende av koncentrationerna av reaktanterna.
På samma sätt, om en reaktant har en reaktionsordning på noll, betyder det att den inte deltar i hastighetsbestämningssteget utan i den snabba.
Första ordningens reaktion
A => B
En första ordningens reaktion regleras av följande skattelag:
V = k [A]
Om koncentrationen av A fördubblas fördubblas reaktionshastigheten V. Därför är hastigheten proportionell mot koncentrationen av reagenset i det avgörande steget i reaktionen..
Andra ordningens reaktion
2A => B
A + B => C
Två arter är involverade i denna typ av reaktion, precis som i de två kemiska ekvationerna som just skrivits. Hastighetslagarna för reaktionerna är:
V = k [A]två
V = k [A] [B]
I den första är reaktionshastigheten proportionell mot kvadratet av koncentrationen av A, medan i den andra sker samma som i första ordningens reaktioner: hastigheten är direkt proportionell mot koncentrationerna av både A och B.
Reaktionsordning mot molekyläritet
Enligt det föregående exemplet kan de stökiometriska koefficienterna eventuellt sammanfalla med reaktionens ordningar.
Detta händer emellertid för elementära reaktioner, som bestämmer molekylmekanismen för varje steg i en reaktion. I dessa reaktioner är koefficienterna lika med antalet deltagande molekyler.
Till exempel reagerar en molekyl A med en av B för att bilda en molekyl av C. Här är molekyliteten 1 för reaktanterna och sedan i uttrycket av hastighetslagen sammanfaller de med reaktionsordningarna.
Av detta följer att molekyliteten alltid måste vara ett heltal och sannolikt mindre än fyra.
Varför? Eftersom det är mycket osannolikt att det går i en mekanism att fyra molekyler deltar samtidigt; två av dem kunde reagera först och sedan skulle de återstående två reagera med denna produkt.
Matematiskt är detta en av de viktigaste skillnaderna mellan reaktionsordningar och molekyläritet: en reaktionsordning kan ta bråkvärden (1/2, 5/2, etc.).
Detta beror på att den förstnämnda bara återspeglar hur artens koncentration påverkar hastigheten, men inte hur deras molekyler ingriper i processen..
Applikationer
- Det gör det möjligt att bestämma den tid som ett läkemedel finns kvar i kroppen innan dess fullständiga ämnesomsättning. På samma sätt, tack vare kinetiska studier, kan enzymatisk katalys följas som gröna metoder jämfört med andra katalysatorer med negativ miljöpåverkan; eller också för att användas i otaliga industriella processer.
- I fordonsindustrin, särskilt inom motorer, där elektrokemiska reaktioner måste utföras snabbt för att fordonet ska kunna starta. Även i dess avgasrör, som har katalysatorer för att omvandla de skadliga gaserna CO, NO och NO.x i COtvå, HtvåO, Ntvå migtvå under optimal tid.
2NaN3(s) = 2Na (s) + 3Ntvå(g)
-Det är reaktionen bakom varför krockkuddar, ”krockkuddarna”, blåser upp när fordon kolliderar. När däcken slår på bromsarna detonerar en detektor elektriskt natriumaziden, NaN3. Detta reagens "exploderar" och frigör Ntvå, som tar upp hela väskans volym snabbt.
Metalliskt natrium reagerar sedan med andra komponenter för att neutralisera det, eftersom det i sitt rena tillstånd är giftigt.
Referenser
- Walter J. Moore. (1963). Fysisk kemi. I Kemisk kinetik. Fjärde upplagan, Longmans.
- Ira N. Levine. (2009). Principer för fysikalisk kemi. Sjätte upplagan, s. 479-540. Mc Graw Hill.
- UAwiki. (23 december 2011). Molekylär-kollisioner-är. [Figur]. Hämtad den 30 april 2018 från: es.m.wikipedia.org
- Glasstone. (1970). Lärobok för fysisk kemi. I Kemisk kinetik. Andra upplagan. D. Van Nostrand, Company, Inc.
- Anne Marie Helmenstine, Ph.D. (8 mars 2017). Definition av kemisk kinetik. Hämtad den 30 april 2018 från: thoughtco.com
- Khan akademin. (2018). Reaktionshastigheter och skattelagar. Hämtad den 30 april 2018 från: khanacademy.org
- Germán Fernández. (26 juli 2010). Kemisk kinetik. Hämtad den 30 april 2018 från: quimicafisica.com



Ingen har kommenterat den här artikeln än.