
Klorgasformel, effekter, användningar och risker
De klorgas (diklor, diatomiskt klor, molekylärt klor eller helt enkelt klor) är en gröngul gas, med en skarp och kvävande lukt, inte brännbar vid rumstemperatur och atmosfärstryck.
Det är det element med den högsta elektronaffiniteten och den tredje högsta elektronegativiteten, bakom endast syre och fluor. Det är extremt reaktivt och ett starkt oxidationsmedel.
Den höga oxiderande potentialen hos elementärt klor ledde till utvecklingen av kommersiella blekmedel och desinfektionsmedel, liksom ett reagens för många processer inom den kemiska industrin..
I form av kloridjoner är klor nödvändigt för alla kända livsartar. Men elementärt klor i höga koncentrationer är extremt farligt och giftigt för alla levande organismer, varför det användes under första världskriget som det första gasformiga kemiska krigsmedlet..

Det är giftigt vid inandning. Långvarig, inandning av låga koncentrationer eller kortvarig, inandning av höga koncentrationer av klorgas har skadliga hälsoeffekter..
Ångor är mycket tyngre än luft och tenderar att bosätta sig i låga områden. Det brinner inte men stöder förbränning. Det är lätt lösligt i vatten. Kontakt med okoncentrerade vätskor kan orsaka förångande kylskador.
Används för att rena vatten, bleka vedmassa och göra andra kemikalier.
Artikelindex
- 1 Formel
- 2 2D-struktur
- 3 funktioner
- 3.1 Fysikaliska och kemiska egenskaper
- 3.2 Reaktivitetsvarningar
- 3.3 Antändlighet
- 3.4 Reaktivitet
- 3.5 Toxicitet
- 4 användningsområden
- 5 Kliniska effekter
- 6 Säkerhet och risker
- 6.1 GHS-faroklasser
- 6.2 Skyddsangivelsekoder
- 7 Referenser
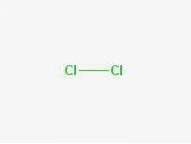
Formel
Formel: Cl-Cl
CAS-nummer: 7782-50-5
2D-struktur

Egenskaper
Fysiska och kemiska egenskaper

Klorgas tillhör den reaktiva gruppen av starka oxidationsmedel. Dessa föreningar reagerar ofta kraftigt med andra föreningar..
Klorgas tillhör också den reaktiva gruppen av starka halogeneringsmedel, som överför en eller flera halogenatomer till den förening med vilken de reagerar..
Halogeneringsmedel är i allmänhet sura och reagerar därför, i vissa fall våldsamt, med baser.
Många av dessa föreningar är reaktiva mot vatten och reaktiva mot luft. Halogener är starkt elektronegativa och starka oxidationsmedel.
Reaktivitetsvarningar
Klorgas är ett starkt oxidationsmedel. Reagerar med vatten. Vatten löser upp klorgas och bildar en blandning av saltsyra och hypoklorsyror.
Eldfarlighet
Det kan antända andra brännbara material (trä, papper, olja, etc.). Blandning med bränslen kan orsaka en explosion. Behållaren kan explodera vid kontakt med eld. Det finns en risk för explosion (och förgiftning) från ansamling av ångor inomhus, i avlopp eller utomhus..
Väte- och klorblandningar (5-95%) kan explodera genom inverkan av nästan vilken form av energi som helst (värme, solljus, gnistor, etc.).
Det avger mycket giftiga ångor vid uppvärmning. I kombination med vatten eller ånga producerar det giftiga och frätande saltsyraångor.
Reaktivitet
Klor reagerar explosivt med (eller stöder förbränning av) många vanliga material.
- Klor tänder stål vid 100 ° C i närvaro av sot, oxid, kol eller andra katalysatorer.
- Slå på torr stålull vid 50 ° C..
- Tänd sulfider vid rumstemperatur.
- Tänder (i flytande form) naturligt och syntetiskt gummi.
- Tänder trialkylboraner och volframdioxid.
- Tänd i kontakt med hydrazin, hydroxylamin och kalciumnitrid.
- Tänds eller exploderar med Arsine, fosfin, silan, diboran, stibin, röd fosfor, vit fosfor, bor, aktivt kol, kisel, arsenik.
- Orsakar antändning och en mjuk explosion när det bubblar genom kall metanol.
- Exploderar eller antänds vid överdriven blandning med ammoniak och upphettas.
- Bildar explosiv kvävetriklorid vid kontakt med Biuret-reagens förorenat med cyanursyra.
- Bildar enkelt explosiva derivat av N-klor med aziridin.
Klor (i flytande eller gasform) reagerar med:
- Alkoholer (explosion)
- Smält aluminium (explosion)
- Silanes (explosion)
- Brompentafluorid
- Koldisulfid (järnkatalyserad explosion)
- Klor-2-propyn (överskott av klor orsakar en explosion)
- Dibutylftalat (Explosion vid 118 ° C)
- Dietyleter (lit)
- Dietyl zink (tänd)
- Glycerol (explosion vid 70-80 ° C)
- Metan på gul kvicksilveroxid (explosion)
- Acetylen (explosion initierad av solljus eller uppvärmning)
- Etylen på kvicksilver, kvicksilver (I) oxid eller silver (I) oxid (explosion orsakad av värme eller ljus)
- Bensin (exoterm reaktion och sedan detonation)
- Blandning av nafta-natriumhydroxid (våldsam explosion)
- Zinkklorid (exoterm reaktion)
- Vax (sprängning)
- Väte (explosion initierad av ljus)
- Järnkarbid
- Uran och zirkonium
- Natrium-, kalium- och kopparhydrider
- Tenn
- Aluminiumpulver
- Vanadinpulver
- Aluminiumfolie
- Glitter
- Kopparfolie
- Kalciumpulver
- Järntråd
- Manganpulver
- Kalium
- Antimonpulver
- Vismut
- Germanium
- Magnesium
- Natrium
- Zink
Giftighet
Klorgas är giftig och kan vara dödlig vid inandning. Kontakt kan orsaka brännskador på hud och ögon, liksom bronkit eller kroniska lungsjukdomar..

Applikationer
Cirka 15 000 klorföreningar används kommersiellt idag. Natriumklorid är den absolut vanligaste klorföreningen och är den viktigaste källan till klor och saltsyra för den enorma klorkemiska industrin..
Av allt producerat elementärt klor används cirka 63% vid tillverkning av organiska föreningar, 18% vid tillverkning av oorganiska klorföreningar, och resterande 19% av producerat klor används till blekmedel och desinfektionsprodukter..

Bland de mest betydelsefulla organiska föreningarna när det gäller produktionsvolym är 1,2-dikloretan och vinylklorid (mellanprodukter vid framställning av PVC), metylklorid, metylenklorid, kloroform, klorid av vinyliden, bland andra.
De viktigaste oorganiska föreningarna inkluderar HCl, Cl20, HOCI, NaCl03, AlCl3, SiCl4, SnCl4, PCl3, PCl5, POCl3, AsCl3, SbCl3, SbCl5, BiCl3, S2Cl2, SCl2, SOCI2, ClF3, ICl, ICl3, MoCl3, TiCl4 , ZnCl2 och många fler.
Klorgas används vid industriell blekning, avloppsvattenbehandling, tillverkning av tabletter för klorering av simbassänger eller vid kemisk krigföring.
Klorgas (känd som bertholite) användes först som ett vapen i första världskriget av Tyskland.
Efter den första användningen använde båda sidor i konflikten klor som ett kemiskt vapen, men det ersattes snart av fosgen och senapsgas, som är mer dödliga..
Klorgas användes också under Irak-kriget i Anbar-provinsen 2007.
Kliniska effekter
Klorgas är en av de vanligaste yrkesmässiga och miljömässiga exponeringarna för irriterande vid inandning. Nya studier har rapporterat att blandningen av blekmedel (blekmedel, huvudsakligen baserad på natriumhypoklorit) med andra rengöringsprodukter, är den vanligaste orsaken (21% av fallen) för enstaka inandningsexponering rapporterad i giftkontrollcentra. Från USA.
De viktigaste toxiska effekterna beror på lokal vävnadsskada snarare än systemisk absorption. Cellskada antas bero på oxidation av funktionella grupper på cellulära komponenter; till reaktioner med vatten i vävnader för att bilda hypoklorsyra och saltsyra; och generering av syrefria radikaler (även om denna idé nu är kontroversiell).
Vid mild till måttlig berusning finns: hosta, andfåddhet, bröstsmärta, brännande känsla i halsen och i det retrosternal området, illamående eller kräkningar, irritation i ögon och näsa, kvävning, muskelsvaghet, yrsel, obehag i buken och huvudvärk.
Vid svår förgiftning finns: övre luftvägsödem, struphuvud, svår lungödem, lunginflammation, ihållande hypoxemi, andningssvikt, akut lungskada och metabolisk acidos.
Kronisk exponering för klorgas är en av de vanligaste orsakerna till yrkesastma. Det kan orsaka dyspné, hjärtklappning, bröstsmärtor, reaktivt syndrom med övre luftvägar, erosion av tandemaljen och ökad förekomst av virussyndrom. Kronisk exponering för 15 ppm orsakar hosta, hemoptys, bröstsmärta och halsont.
Dermal exponering kan orsaka erytem i huden, smärta, irritation och brännskador. Allvarlig exponering kan orsaka kardiovaskulär kollaps och andningsstopp. I höga koncentrationer kan synkope och nästan omedelbar död förekomma. Klor (som hypoklorit) är teratogent hos försöksdjur.
Säkerhet och risker
Faroangivelser från det globalt harmoniserade systemet för klassificering och märkning av kemikalier (GHS).
Det globalt harmoniserade systemet för klassificering och märkning av kemikalier (GHS) är ett internationellt överenskomet system, skapat av FN, utformat för att ersätta de olika klassificerings- och märkningsstandarder som används i olika länder genom att använda enhetliga kriterier på global nivå (Nations United, 2015 ).
Faroklasserna (och deras motsvarande GHS-kapitel), klassificerings- och märkningsstandarder och rekommendationer för klorgas är följande (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):
GHS-faroklasser
H270: Kan orsaka eller intensifiera brand; Oxideringsmedel [Fara Oxiderande gaser - Kategori 1]
H280: Innehåller gas under tryck; Kan explodera vid uppvärmning [Varningsgaser under tryck - komprimerad gas, flytande gas, upplöst gas]
H315: Orsakar hudirritation [Varning Frätning / irritation på huden - Kategori 2]
H319: Orsakar allvarlig ögonirritation [Varning Allvarlig ögonskada / ögonirritation - Kategori 2A]
H330: Dödlig vid inandning [Fara Akut toxicitet, inandning - Kategori 1, 2]
H331: Giftigt vid inandning [Fara Akut toxicitet, inandning - Kategori 3]
H335: Kan orsaka irritation i luftvägarna [Varning Specifik organtoxicitet, enstaka exponering; Luftvägsirritation - Kategori 3]
H400: Mycket giftigt för vattenlevande organismer [Varning Farligt för vattenmiljön, akut fara - Kategori 1]
H410: Mycket giftigt för vattenlevande organismer med långvariga effekter [Varning Farligt för vattenmiljön, långvarig fara - Kategori 1]
(PubChem, 2017)
Skyddsangivelsekoder
P220, P244, P260, P261, P264, P271, P273, P280, P284, P302 + P352, P304 + P340, P305 + P351 + P338, P310, P311, P312, P320, P321, P332 + P313, P337 + P P362, P370 + P376, P391, P403, P403 + P233, P405, P410 + P403 och P501.
Referenser
- Benjah-bmm27 (2007). Diklor-gas-3D-vdW [bild]. Återställd från: commons.wikimedia.org.
- Bundesarchiv (1915). Deutsche Soldaten versprühen künstlichen Nebel [bild]. Återställd från: commons.wikimedia.org.
- ChemIDplus (2017) 3D-struktur av 7782-50-5 - Klor [bild] Återställd från: chem.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Datablad för reaktiv grupp. Oxiderande medel, starka. Silver Spring, MD. EU; Återställd från: cameochemicals.noaa.gov.
- Oelen, W., (2005). Klorgas i en flaska [bild]. Återställd från: commons.wikimedia.org.
- Sargent, J., (1918). Förgasad [bild]. Återställd från: en.wikipedia.org.
- Tomia (2006). Plastic-recyc-03 [bild]. Återställd från: commons.wikimedia.org.
- Wikipedia (2017). Klor. Återställd från: en.wikipedia.org.



Ingen har kommenterat den här artikeln än.