
Galvaniska korrosionsmekanismer, exempel, skydd
De galvanisk eller elektrokemisk korrosion Det är en process genom vilken en metall eller legering bryts ned snabbare jämfört med dess konventionella oxidation. Det kan sägas att det är en accelererad oxidation och till och med avsiktligt försonad; som det händer i celler eller batterier.
Detta sker under ett antal förhållanden. Först måste det finnas en aktiv metall, kallad anoden. Och för det andra måste det finnas en lågreaktiv ädelmetall som kallas katoden. De tredje och fjärde förhållandena är närvaron av ett medium där elektroner förökas, såsom vatten, och joniska arter eller elektrolyter..

Galvanisk korrosion kan observeras särskilt i marina miljöer eller vid stränderna. Luftströmmar höjer massor av vattenånga, som i sin tur bär några joner; det senare hamnar i ett tunt lager vatten eller droppar som vilar på metallytan.
Dessa fuktighets- och salthaltförhållanden gynnar metallets korrosion. Det vill säga en järnkrona som den i bilden ovan rostar snabbare om den utsätts för havets närhet..
Den lätthet som en metall måste oxidera jämfört med en annan kan mätas kvantitativt genom dess reduktionspotentialer. kemiböcker finns i överflöd med tabeller med dessa potentialer E. Ju mer negativ den är, desto större är lutningen på rost.
På samma sätt, om denna metall är i närvaro av en annan med en mycket positiv reduktionspotential, och därmed har en stor AE, kommer oxidationen av den reaktiva metallen att bli mer aggressiv. Andra faktorer, såsom pH, jonstyrka, fukt, närvaron av syre och förhållandet mellan områdena av metallen som oxideras och att den reduceras, är också viktiga..
Artikelindex
- 1 Mekanismer
- 1.1 Begrepp och reaktioner
- 1.2 Avpolarisatorer
- 1.3 Järnkorrosion
- 2 Exempel
- 2.1 Anodiska index
- 3 Skydd mot elektrokemisk korrosion
- 3.1 Offerbeläggningar
- 3.2 Ädla beläggningar
- 4 Experiment för barn
- 4.1 Järnplatta i lösning av kopparsalter
- 4.2 Rengöring av silveroxid
- 5 Referenser
Mekanismer
Begrepp och reaktioner
Innan man tar upp mekanismerna bakom galvanisk korrosion bör vissa begrepp klargöras.
I en redoxreaktion förlorar en art elektroner (oxiderar) medan en annan får dem (minskar). Elektroden på vilken oxidation sker kallas anoden; och på vilken reduktionen sker, katod (på engelska mnemonic rule redcat att komma ihåg).
Således, för en elektrod (ett stycke, skruv, etc.) av en metall M, om den oxiderar sägs den vara anoden:
M => Mn+ + ne-
Antalet frigjorda elektroner kommer att vara lika med storleken på den positiva laddningen för katjonen Mn+ resulterande.
Sedan tar en annan elektrod eller metall R (båda metallerna måste vara i kontakt på något sätt), mottager de frigjorda elektronerna; men detta genomgår ingen kemisk reaktion om det får elektroner, eftersom det bara skulle leda dem (elektrisk ström).
Därför måste det finnas en annan art i lösning som formellt kan acceptera dessa elektroner; som lätt reducerade metalljoner, till exempel:
Rn+ + ne- => R
Det vill säga ett metallskikt R skulle bildas och elektroden skulle därför bli tyngre; medan metallen M skulle förlora massa på grund av att dess atomer löstes upp.
Avpolarisatorer
Tänk om det inte fanns några metallkatjoner som kunde reduceras tillräckligt enkelt? I så fall tar andra arter som finns i mediet elektronerna: depolarisatorerna. Dessa är nära besläktade med pH: Otvå, H+, Åh- och HtvåELLER.
Syre och vatten får elektroner i en reaktion uttryckt av följande kemiska ekvation:
ELLERtvå + 2HtvåO + 4e- => 4OH-
Medan H-jonerna+ förvandlas till Htvå:
2H+ + 2e- => Htvå
Det vill säga arten OH- och Htvå är vanliga produkter av galvanisk eller elektrokemisk korrosion.
Även om metallen R inte deltar i någon reaktion, främjar det faktum att den är mer ädel än M dess oxidation; och följaktligen kommer det att finnas en högre produktion av OH-joner- eller vätgas. Eftersom det trots allt är skillnaden mellan reduktionspotentialerna, AE, en av de viktigaste drivkrafterna för dessa processer.
Järnkorrosion
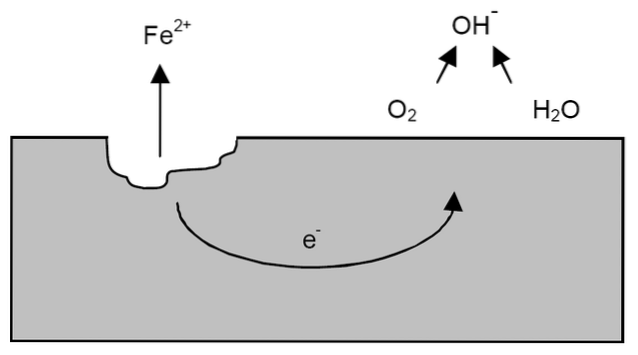
Efter de tidigare förtydligandena kan exemplet på järnkorrosion tas upp (toppbild). Anta att det finns ett tunt lager vatten där syre löses upp. Utan närvaron av andra metaller är det depolarisatorerna som kommer att sätta riktlinjerna för reaktionen.
Således kommer järn att förlora vissa atomer från dess yta för att lösa sig i vatten som Fe-katjoner.två+:
Tro => Trotvå+ + 2e-
De två elektronerna färdas genom järnstycket eftersom det är en bra ledare för elektricitet. Så var oxidationen eller anodplatsen startade är känd; men inte var reduktionen kommer att fortsätta eller placeringen av den katodiska platsen. Katodplatsen kan vara var som helst; och ju större dess möjliga område desto sämre korroderar metallen.
Antag att elektronerna når en punkt som visas i bilden ovan. Där genomgår både syre och vatten den redan beskrivna reaktionen, genom vilken OH frigörs-. Dessa OH-anjoner- kan reagera med Fetvå+ för att bilda Fe (OH)två, som fäller ut och genomgår efterföljande oxidationer som slutligen förvandlar det till rost.
Under tiden spricker anodplatsen mer och mer.
Exempel
I vardagen är exemplen på galvanisk korrosion många. Vi behöver inte hänvisa till järnkronan: alla artefakter gjorda av metaller kan genomgå samma process i närvaro av fuktiga och salta miljöer.
Förutom stranden kan vintern också ge perfekta förutsättningar för korrosion; till exempel när du skyver salt i snön på vägen för att förhindra att bilar slirar.
Ur fysikalisk synvinkel kan fukt kvarhållas i de svetsade fogarna av två metaller, som är aktiva platser för korrosion. Detta beror på att båda metallerna beter sig som två elektroder, och den mer reaktiva kommer att förlora sina elektroner..
Om produktionen av OH-joner- Det är betydande, det kan till och med korrodera färgen på bilen eller anordningen i fråga.
Anodiska index
Man kan bygga sina egna exempel på galvanisk korrosion med hjälp av reduktionspotentialtabellerna. Emellertid kommer den anodiska indextabellen (förenklad i sig) att väljas för att illustrera denna punkt..
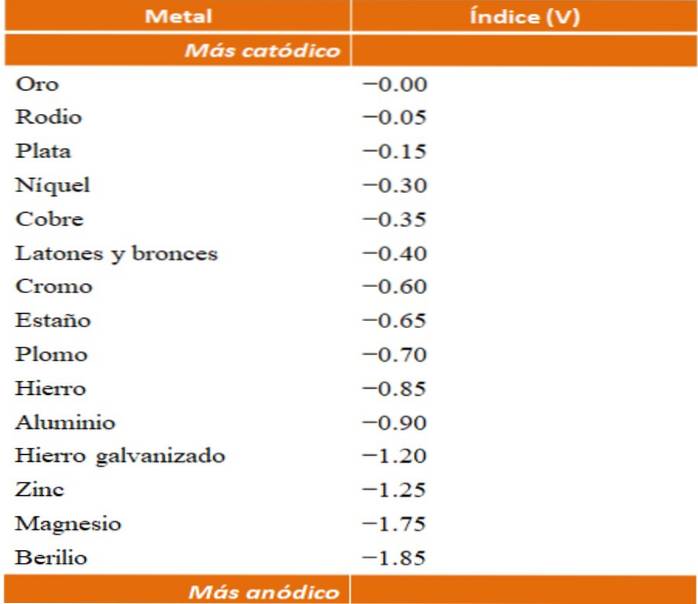
Antag till exempel att vi ville bygga en elektrokemisk cell. Metallerna som är överst i tabellen med anodiska index är mer katodiska; det vill säga de minskas lätt och det blir därför svårt att ha dem i lösning. Medan metallerna som är längst ner är mer anodiska eller reaktiva och korroderar de lätt.
Om vi väljer guld och beryllium kunde inte båda metallerna vara tillsammans länge, eftersom beryllium skulle oxidera extremt snabbt..
Och om vi å andra sidan har en lösning av Ag-joner+ och vi sänker ner en aluminiumstång i den, detta kommer att lösas upp samtidigt som metalliska silverpartiklar fälls ut. Om denna stapel var ansluten till en grafitelektrod, skulle elektroner färdas till den för att elektrokemiskt avsätta silver på den som en silverfilm..
Och om den istället för aluminiumstången var gjord av koppar, skulle lösningen bli blåaktig på grund av närvaron av Cu-joner.två+ i vatten.
Elektrokemisk korrosionsskydd
Offerbeläggningar
Antag att du vill skydda ett zinkark från korrosion i närvaro av andra metaller. Det enklaste alternativet skulle vara att tillsätta magnesium, vilket skulle täcka zinken så att elektronerna som frigörs från magnesium, när de oxiderats, minskar Zn-katjonerna.två+ tillbaka.
Emellertid skulle MgO-filmen på zink sluta spricka förr snarare än senare och ge anodplatser med hög strömtäthet; det vill säga korrosion av zink skulle accelerera kraftigt precis vid dessa punkter.
Denna elektrokemiska korrosionsskyddsteknik är känd som användning av offerbeläggningar. Den mest kända är zink, som används i den berömda tekniken som kallas galvanisering. I dem är metall M, särskilt järn, belagd med zink (Fe / Zn).
Återigen oxiderar zinken och dess oxid tjänar till att täcka järnet och överföra elektroner till det som minskar Fetvå+ som kan bildas.
Ädla beläggningar
Antag igen att du vill skydda samma zinkark, men nu använder du krom istället för magnesium. Krom är mer ädelt (mer katodiskt, se tabell med anodiska index) än zink och fungerar därför som en ädel beläggning.
Problemet med denna typ av beläggning är att när den spricker kommer den att ytterligare främja och påskynda oxidationen av metallen under; i detta fall korroderar zinken ännu mer än att beläggas med magnesium.
Och slutligen finns det andra beläggningar som består av färger, plast, antioxidanter, fetter, hartser etc..
Experiment för barn
Järnplatta i upplösning av kopparsalter
Ett enkelt experiment kan utformas från samma tabell med anodindex. Lösa upp en rimlig mängd (mindre än 10 gram) CuSO45HtvåEller i vatten uppmanas ett barn att doppa i en polerad järnplatta. Ett foto tas och processen får utvecklas i ett par veckor.
Lösningen är initialt blåaktig men börjar blekna medan järnplattan blir en koppar färg. Detta beror på att koppar är mer ädla än järn, och därför är dess katjoner Cutvå+ De kommer att reduceras till metalliskt koppar från jonerna som ges av oxidationen av järn:
Tro => Trotvå+ + 2e-
Cutvå+ + 2e- => Cu
Rengöring av silveroxid
Silverföremål blir svarta över tiden, särskilt om de är i kontakt med en svavelföreningskälla. Dess rost kan avlägsnas genom att nedsänka föremålet i ett badkar med vatten med natron och aluminiumfolie. Bikarbonatet ger elektrolyterna som underlättar transporten av elektroner mellan objektet och aluminiumet.
Som ett resultat kommer barnet att uppskatta att objektet tappar sina svarta fläckar och lyser med sin karakteristiska silverfärg; medan aluminiumfolien korroderar för att försvinna.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Wikipedia. (2019). Galvanisk korrosion. Återställd från: en.wikipedia.org
- Stephen Lower. (16 juni 2019). Elektrokemisk korrosion. Kemi LibreTexts. Återställd från: chem.libretexts.org
- Det öppna universitetet. (2018). 2.4 Korrosionsprocesser: galvanisk korrosion. Återställd från: open.edu
- Kundtjänst Service Brush Wellman Inc. (s.f.). En guide till galvanisk korrosion. Borsta Wellman konstruerade material.
- Giorgio Carboni. (1998). Experiment inom elektrokemi. Återställd från: funsci.com



Ingen har kommenterat den här artikeln än.