
Henderson-Hasselbalch ekvationsförklaring, exempel, övning
De Henderson-Hasselbalch ekvation är ett matematiskt uttryck som gör det möjligt att beräkna pH för en buffert eller buffertlösning. Den är baserad på syrans pKa och förhållandet mellan koncentrationerna av konjugatbasen eller saltet och syran, som finns i buffertlösningen..
Ekvationen utvecklades ursprungligen av Lawrence Joseph Henderson (1878-1942) 1907. Denna kemist etablerade komponenterna i hans ekvation baserat på kolsyra som buffert eller buffert..
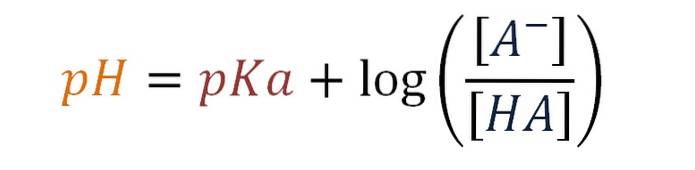
Senare introducerade Karl Albert Hasselbalch (1874-1962) 1917 användningen av logaritmer för att komplettera Henderson-ekvationen. Den danska kemisten studerade reaktionerna av blod med syre och effekten på dess pH.
En buffertlösning kan minimera de pH-förändringar som en lösning genomgår genom att tillsätta en volym stark syra eller bas. Den består av en svag syra och dess starka konjugatbas som snabbt dissocieras.
Artikelindex
- 1 Förklaring
- 1.1 Matematisk utveckling
- 1.2 Ekvation för en svag bas
- 2 Hur fungerar en buffert??
- 2.1 Dämpning
- 2.2 Buffertkapacitet
- 3 Exempel på Henderson-ekvationer
- 3.1 Acetatstötdämpare
- 3.2 Kolsyrabuffert
- 3.3 Laktatbuffert
- 3.4 Fosfatbuffert
- 3.5 Oxihemoglobin
- 3.6 Deoxihemoglobin
- 4 Lösta övningar
- 4.1 Övning 1
- 4.2 Övning 2
- 4.3 Övning 3
- 5 Referenser
Förklaring
Matematisk utveckling
En svag syra i en vattenlösning dissocieras enligt lagen om massaktion, enligt följande schema:
HA + HtvåO ⇌ H+ + TILL-
HA är den svaga syran och A.- dess konjugerade bas.
Denna reaktion är reversibel och har en jämviktskonstant (Ka):
Ka = [H+] · [TILL-] / [HA]
Ta logaritmer:
log Ka = log [H+] + Logg [A-] - logg [HA]
Om varje term i ekvationen multipliceras med (-1) uttrycks den enligt följande:
- log Ka = - log [H+] - logg [A] + logg [HA]
- log Ka definieras som pKa och - log [H+] definieras som pH. Efter att ha gjort rätt substitution minskar det matematiska uttrycket till:
pKa = pH - log [A-] + Logg [HA]
Lösning för pH och omgruppering av termer uttrycks ekvationen enligt följande:
pH = pKa + log [A-] / [HA]
Detta är ekvationen för Henderson-Hasselbalch för en svag syrabuffert.
Ekvation för en svag bas
På samma sätt kan en svag bas bilda en buffert, och Henderson-Hasselbalch-ekvationen för den är som följer:
pOH = pKb + log [HB] / [B-]
De flesta buffertlösningarna har dock sitt ursprung, även de av fysiologisk betydelse, från dissociationen av en svag syra. Därför är det mest använda uttrycket för Henderson-Hasselbalch-ekvationen:
pH = pKa + log [A-] / [HA]
Hur fungerar en buffert?
Dämpande åtgärder
Henderson-Hasselbalch-ekvationen indikerar att denna lösning består av en svag syra och en stark konjugatbas uttryckt som ett salt. Denna komposition tillåter buffertlösningen att förbli vid ett stabilt pH även när starka syror eller baser tillsätts..
När en stark syra tillsätts till bufferten reagerar den med konjugatbasen för att bilda ett salt och vatten. Detta neutraliserar syran och låter pH-variationen vara minimal..
Om en stark bas tillsätts till bufferten reagerar den nu med den svaga syran och bildar vatten och ett salt, vilket neutraliserar effekten av den tillsatta basen på pH. Därför är pH-variationen minimal.
PH i en buffertlösning beror på förhållandet mellan koncentrationerna av konjugatbasen och den svaga syran, och inte av det absoluta värdet av koncentrationerna av dessa komponenter. En buffertlösning kan spädas med vatten och pH-värdet är praktiskt taget oförändrat.
Buffertkapacitet
Buffringskapaciteten beror också på pKa för den svaga syran, liksom koncentrationerna av den svaga syran och konjugatbasen. Ju närmare buffertens pH är pKa för syran, desto större är dess buffringskapacitet..
På samma sätt är ju högre koncentrationen av komponenterna i buffertlösningen, desto större är dess buffringskapacitet..
Exempel på Henderson-ekvationer
Acetat stötdämpare
pH = pKa + log [CH3KUTTRA-] / [CH3COOH]
pKa = 4,75
Kolsyrabuffert
pH = pKa + log [HCO3-] / [HtvåCO3]
pKa = 6,11
Den övergripande processen som leder till bildandet av bikarbonatjonen i en levande organism är emellertid följande:
COtvå + HtvåO ⇌ HCO3- + H+
Att vara COtvå en gas, dess koncentration i lösning uttrycks som en funktion av dess partiella tryck.
pH = pka + log [HCO3-] / a pCOtvå
a = 0,03 (mmol / L) / mmHg
pCOtvå är partialtrycket av COtvå
Och då skulle ekvationen se ut:
pH = pKa + log [HCO3-] / 0,03 pCOtvå
Laktatbuffert
pH = pKa + log [laktatjon] / [mjölksyra]
pKa = 3,86
Fosfatbuffert
pH = pKa + log [dibasiskt fosfat] / [monobasiskt fosfat]
pH = pKa + log [HPO4två-] / [HtvåPO4-]
pKa = 6,8
Oxihemoglobin
pH = pKa + log [HbOtvå-] / [HHbOtvå]
pKa = 6,62
Deoxihemoglobin
pH = pKa + log [Hb-] / HbH
pKa = 8,18
Lösta övningar
Övning 1
Fosfatbufferten är viktig för att reglera kroppens pH, eftersom dess pKa (6,8) ligger nära det pH som finns i kroppen (7,4). Vad blir värdet på relationen [NatvåHPO4två-] / [NaHtvåPO4-] av Henderson-Hasselbalch-ekvationen för ett pH-värde = 7,35 och ett pKa = 6,8?
NaH-dissociationsreaktionentvåPO4- det är:
NaHtvåPO4- (syra) ⇌ NaHPO4två- (bas) + H+
pH = pKa + log [NatvåHPO4två-] / [NaHtvåPO4-]
Lösning av förhållandet [konjugatbas / syra] för fosfatbufferten har vi:
7,35 - 6,8 = log [NatvåHPO4två-] / [NaHtvåPO4-]
0,535 = log [NatvåHPO4två-] / [NaHtvåPO4-]
100,535 = 10logga [Na2HPO4] / [NaH2PO4]
3,43 = [NatvåHPO4två-] / [NaHtvåPO4-]
Övning 2
En acetatbuffert har en ättiksyrakoncentration på 0,0135 M och en natriumacetatkoncentration på 0,0260 M. Beräkna buffertens pH, med vetskap om att pKa för acetatbuffert är 4,75.
Dissociationsjämvikten för ättiksyra är:
CH3COOH ⇌ CH3KUTTRA- + H+
pH = pKa + log [CH3KUTTRA-] / [CH3COOH]
Ersätta de värden vi har:
[CH3KUTTRA-] / [CH3COOH] = 0,0260 M / 0,0135 M
[CH3KUTTRA-] / [CH3COOH] = 1,884
log 1.884 = 0.275
pH = 4,75 + 0,275
pH = 5,025
Övning 3
En acetatbuffert innehåller 0,1 M ättiksyra och 0,1 M natriumacetat. Beräkna buffertens pH efter tillsats av 5 ml 0,05 M saltsyra till 10 ml av ovanstående lösning.
Det första steget är att beräkna den slutliga koncentrationen av HCl när den blandas med buffertlösningen:
ViCi = VfCf
Cf = Vi · (Ci / Vf)
= 5 ml · (0,05 M / 15 ml)
= 0,017 M
Saltsyra reagerar med natriumacetat för att bilda ättiksyra. Därför minskar natriumacetatkoncentrationen med 0,017 M och ättiksyrakoncentrationen ökar med samma mängd:
pH = pKa + log (0,1 M - 0,017 M) / (0,1 M + 0,017 M)
pH = pKa + log 0,083 / 0,017
= 4,75 - 0,149
= 4,601
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Jimenez Vargas och J. Mª Macarulla. (1984). Fysiologisk fysikalisk kemi. 6: e upplagan. Redaktionellt Interamericana.
- Wikipedia. (2020). Henderson-Hasselbalch-ekvation. Återställd från: en.wikipedia.org
- Gurinder Khaira & Alexander Kot. (05 juni 2019). Henderson-Hasselbalch approximation. Kemi LibreTexts. Återställd från: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (29 januari 2020). Henderson Hasselbalch Ekvationsdefinition. Återställd från: thoughtco.com
- Redaktörerna för Encyclopaedia Britannica. (6 februari 2020). Lawrence Joseph Henderson. Encyclopædia Britannica. Återställd från: britannica.com


Ingen har kommenterat den här artikeln än.