
Kemiska ekvationsdelar och exempel

De kemisk ekvation det är en schematisk framställning av några av egenskaperna hos en kemisk reaktion. Det kan också sägas att den kemiska ekvationen beskriver förändringarna som upplevs av de olika ämnen som är involverade i en reaktion.
Formlerna och symbolerna för de olika deltagande ämnena placeras i den kemiska ekvationen, vilket tydligt anger antalet atomer för varje element som finns i föreningarna, vilket visas som ett abonnemang och inte kan ändras genom att balansera ekvationen.
Den kemiska ekvationen måste verka balanserad, det vill säga antalet atomer för både reaktanter och produkter måste vara lika. På detta sätt följs lagen om bevarande av materia. Det är önskvärt att siffrorna som används för att balansera ekvationerna är heltal.
Dessa ekvationer avslöjar inte de på varandra följande stegen, inte heller genom vilka mekanismer reaktanterna omvandlas till produkter..
Det är därför, även om de är mycket användbara för att förstå vart en kemisk reaktion går, tillåter det oss inte att förstå dess molekylära aspekter eller hur den påverkas av vissa variabler; såsom pH, viskositet, reaktionstid, omrörningshastighet, bland andra.
Artikelindex
- 1 Delar av en kemisk ekvation
- 1.1 Plats för reagenser och produkter
- 1.2 Balansera kemiska ekvationer
- 1.3 Fysiska tillstånd för komponenterna i den kemiska ekvationen
- 1.4 Förändringar i fysiskt tillstånd
- 2 Exempel på kemiska ekvationer
- 2.1 - Fotosyntes
- 2.2 - Cellandning
- 2.3 - Reaktioner av vanliga element
- 3 Referenser
Delar av en kemisk ekvation
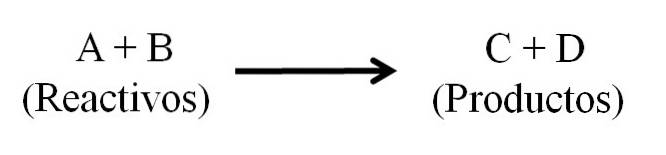
Det finns i princip tre huvuddelar till en kemisk ekvation: reaktanterna, produkterna och pilen som anger riktningen för den kemiska reaktionen..
Plats för reagenser och produkter
Alla ämnen som fungerar som reaktanter och alla de som är produkter visas i den kemiska ekvationen. Dessa grupper av ämnen är åtskilda av en pil som anger reaktionens riktning. Reagenser finns till vänster om pilen och produkter till höger.
Pilen betyder det som produceras och är orienterat från vänster till höger (→), även om det i reversibla reaktioner finns två ekvivalenta och parallella pilar; en riktad till höger och en till vänster. Symbolen (Δ) placeras vanligtvis ovanför pilen, vilket indikerar att värme användes i reaktionen..
Dessutom placeras katalysatorns identifiering vanligtvis på pilen, om möjligt med dess formel eller symbol. De olika ämnena som visas som reaktanter är åtskilda av tecknet (+), vilket indikerar att ämnena reagerar eller kombineras med varandra.
När det gäller ämnen som visas som produkter har inte tecknet (+) den tidigare konnotationen; om inte reaktionen är reversibel. Det är bekvämt att tecknet (+) placeras lika långt från de ämnen som det separerar.
Balansera kemiska ekvationer
Det är ett väsentligt krav att de kemiska ekvationerna är korrekt balanserade. För detta placeras ett tal som kallas den stökiometriska koefficienten. När det är nödvändigt måste denna koefficient gå före de ämnen som visas som reaktanter eller produkter..
Detta för att uppnå att antalet alla atomer i elementen som framträder som reaktanter är exakt lika med antalet av dem som förekommer i produkten. Den enklaste metoden för att balansera kemiska ekvationer är försök och fel..
Fysiska tillstånd för komponenterna i den kemiska ekvationen
I vissa kemiska ekvationer är ämnens fysiska tillstånd markerat med ett underskrift. För detta används följande förkortningar på spanska: (s) för fast tillstånd; (l) för flytande tillstånd, (g), gasformigt tillstånd; och (ac), vattenlösning.
Exempel: reaktion av kalciumkarbonat med saltsyra.
Tjuv3 (s) + 2 HCl(ac) → CaCl2 (s) + HtvåELLER(l) + CO2 g)
Förändringar i fysiskt tillstånd
I vissa fall anges det i den kemiska ekvationen om det bildas en gas i den kemiska reaktionen eller om det förekommer utfällning av något av de ämnen som produceras.
Närvaron av en gas indikeras med en vertikal pil med änden uppåt (↑), placerad på höger sida av det gasformiga ämnet.
Exempel: reaktion av zink med saltsyra.
Zn + 2 HCl → ZnCltvå + Htvå↑
Om en av ämnena i den kemiska reaktionen bildar en fällning, symboliseras detta genom att placera en vertikal pil med änden nedåt (↓), placerad på höger sida av det utfällda ämnet..
Exempel: reaktion av saltsyra med silvernitrat.
HCl + AgNO3 → HNO3 + AgCl ↓
Exempel på kemiska ekvationer
- Fotosyntes

Fotosyntes är en process genom vilken växter fångar upp och omvandlar ljusenergi, som kommer från solljus, för att generera den energi som behövs för deras uppehälle. Fotosyntes utförs av vissa organeller av växtceller som kallas kloroplaster.
Thylakoids finns i kloroplastmembranet, platser där klorofyll finns. till Y b, vilka är de viktigaste pigmenten som fångar upp ljusenergi.
Även om fotosyntes är en komplex process kan den beskrivas i följande kemiska ekvation:
6 COtvå + 6 timmartvåO → C6H12ELLER6 + 6 Otvå↑ ΔGº = 2,870 kJ / mol
C6H12ELLER6 Det är formeln för glukos, ett kolhydrat som metaboliseras för produktion av ATP; förening som är den viktigaste energibehållaren i de flesta levande saker. Dessutom genereras NADPH från glukos, ett koenzym som är nödvändigt för många reaktioner..
- Cellandningen
Celler använder syre för metabolismen av många ämnen som finns i intagen mat. Samtidigt används ATP som en energikälla för aktiviteter som utförs av levande varelser, som producerar koldioxid och vatten i dessa processer..
Om glukos används som modell för ett metaboliserat ämne kan andningen schematiseras med hjälp av följande kemiska ekvation:
C6H12ELLER6 + 6 Otvå → 6 COtvå + 6 timmartvåELLER
- Vanliga elementreaktioner
Sönderdelningsreaktion
En förening eller föreningar dissocierar och bildar andra olika föreningar med sina atomer:
2 KClO3 (s) → 2 KCl(s) + 3 O2 g)
Förskjutningsreaktion
En metall reagerar med en förening och ersätter en metall som finns i den:
Mg(s) + KURS4 (ac) → Cu(s) + MgSO4 (ac)
Eliminationsreaktion
I denna typ av reaktion minskar antalet atomer eller grupper som är fästa vid en kolatom:
CH3-CHtvåBr + NaOH → HtvåC = CHtvå + HtvåO + NaBr
Hydreringsreaktion
Det är en reaktion där en förening tillför en molekyl vatten. Denna reaktion är viktig vid beredningen av alkoholer:
HtvåC = CHtvå + HtvåO → HtvåC-CHtvåÅh
Neutraliseringsreaktion
En bas eller alkali reagerar med en syra som producerar salt och vatten:
HCl(ac) + NaOH(ac) → NaCl(ac) + HtvåELLER(l)
Syntesreaktion
I denna typ av reaktion kombineras två eller flera ämnen för att skapa en ny förening:
2 Li(s) + Cl2 g) → 2 LiCl(s)
Dubbelförskjutningsreaktion (metates)
I denna typ av reaktion sker utbyte av positiva och negativa joner för att bilda nya föreningar:
AgNO3 (ac) + NaCl(ac) → AgCl(s) + Äldre bror3 (ac)
Referenser
- Flores, J. (2002). Kemi. Utgåva 1det var. Redaktionellt Santillana
- Mathews, C. K., Van Holde, K. E. och Ahern, K. G. (2002). Biokemi. 3det var Utgåva. Utgivare Pearson Addison Wesley
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Wikipedia. (2019). Kemisk ekvation. Återställd från: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (20 september 2019). Vad är en kemisk ekvation? Återställd från: thoughtco.com



Ingen har kommenterat den här artikeln än.