
Elektronegativitetsskalor, variation, nytta och exempel

De elektronnegativitet det är en relativ periodisk egenskap som berör en atoms förmåga att locka elektrontäthet från dess molekylära miljö. Det är en atoms tendens att attrahera elektroner när den är fäst vid en molekyl. Detta återspeglas i beteendet hos många föreningar och i hur de interagerar intermolekylärt med varandra..
Inte alla element drar elektroner från angränsande atomer i samma grad. När det gäller de som enkelt ger elektrontäthet sägs det att de är det elektropositiv, medan de som är "täckta" med elektroner är elektronegativ. Det finns många sätt att förklara och observera denna egenskap (eller koncept).
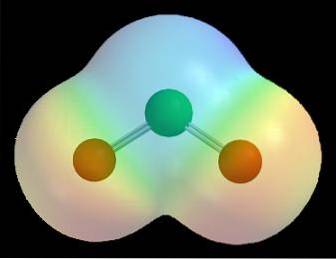
Till exempel i elektrostatiska potentialkartor för en molekyl (som den för klordioxid i bilden ovan, ClOtvå) effekten av de olika elektronegativiteterna för klor- och syreatomer observeras.
Den röda färgen indikerar de elektronrika regionerna i molekylen, δ-, och den blå färgen indikerar de elektronfattiga regionerna, δ +. Efter en serie beräkningsberäkningar kan denna typ av karta således fastställas; många av dem visar ett direkt samband mellan placeringen av elektronegativa atomer och δ-.
Det kan också visualiseras enligt följande: inom en molekyl är det mer troligt att elektrontransit sker i närheten av de mest elektronegativa atomerna. Det är av den anledningen som för ClOtvå syreatomerna (de röda sfärerna) omges av ett rött moln, medan kloratomen (den gröna sfären) omges av ett blåaktigt moln.
Definitionen av elektronegativitet beror på förhållningssättet till fenomenet, det finns flera skalor som betraktar det ur vissa aspekter. Men alla skalor har gemensamt att de stöds av atomernas inneboende natur.
Artikelindex
- 1 Elektronegativitetsskalor
- 1.1 Pauling-skala
- 1.2 Mulliken skala
- 1.3 Skala av A.L. Allred och E. Rochow
- 2 Hur varierar elektronegativiteten i det periodiska systemet?
- 2.1 Atomen i molekylen
- 3 Vad är det för??
- 4 Exempel (klor, syre, natrium, fluor)
- 5 Referenser
Elektronegativitetsskalor
Elektronegativitet är inte en egenskap som kan kvantifieras och har inte heller absoluta värden. Varför? Eftersom en atoms tendens att attrahera elektrontäthet mot den inte är densamma i alla föreningar. Med andra ord: elektronegativitet varierar beroende på molekylen.
Ja för ClO-molekylentvå Om Cl-atomen byttes mot N-atomen, skulle tendensen hos O att attrahera elektroner också förändras; det kan öka (göra molnet rödare) eller minska (tappa färg). Skillnaden skulle ligga i den nya N-O-bindningen som bildades, så att O-N-O-molekylen (kvävedioxid, NOtvå).
Eftersom en atoms elektronegativitet inte är densamma för alla dess molekylära omgivningar är det nödvändigt att definiera den i termer av andra variabler. På detta sätt finns det värden som fungerar som referens och som möjliggör förutsägelse, till exempel, vilken typ av bindning som bildas (jonisk eller kovalent).
Pauling-skala
Den stora forskaren och vinnaren av två Nobelpriser, Linus Pauling, föreslog 1932 en kvantitativ (mätbar) form av elektronregativet som kallas Pauling-skalan. I den var elektronegativiteten för två element, A och B, som bildade bindningar, relaterad till den extra energi som är associerad med den joniska karaktären av bindningen A-B.
Hur är detta? Teoretiskt är kovalenta bindningar de mest stabila, eftersom fördelningen av deras elektroner mellan två atomer är rättvis; det vill säga för molekylerna A-A och B-B delar båda atomerna paret elektroner av bindningen på samma sätt. Men om A är mer elektronegativ, kommer nämnda par att vara mer av A än av B.
I detta fall är A-B inte längre helt kovalent, även om deras elektronegativiteter inte skiljer sig mycket, kan man säga att deras bindning har en hög kovalent karaktär. När detta händer genomgår bindningen en liten instabilitet och förvärvar extra energi som en produkt av elektronegativitetsskillnaden mellan A och B.
Ju större denna skillnad är, desto större är energin hos A-B-bindningen, och följaktligen desto större är jonkaraktären hos nämnda bindning..
Denna skala representerar det mest använda inom kemi, och elektronegativitetsvärdena uppstod från tilldelningen av ett värde på 4 för fluoratomen. Därifrån kunde de beräkna de andra elementens.
Mulliken skala
Medan Pauling-skalan har att göra med energin associerad med bindningarna, är Robert Mulliken-skalan mer relaterad till två andra periodiska egenskaper: joniseringsenergi (EI) och elektronaffinitet (AE).
Således är ett element med höga EI- och AE-värden mycket elektronegativt och kommer därför att locka elektroner från sin molekylära miljö..
Varför? Eftersom EI återspeglar hur svårt det är att "rippa" en extern elektron från den, och AE hur stabil är anjonen som bildas i gasfasen. Om båda egenskaperna har stora magnituder är elementet "älskare" av elektroner..
Mullikens elektronegativiteter beräknas med följande formel:
ΧM = ½ (EI + AE)
Det vill säga χM är lika med medelvärdet för EI och AE.
Till skillnad från Pauling-skalan, som beror på vilka atomer som bildar bindningar, är den emellertid relaterad till valens-tillståndets egenskaper (med sina mest stabila elektroniska konfigurationer).
Båda skalorna genererar liknande elektronegativitetsvärden för elementen och är ungefär relaterade till följande omvandling:
ΧP = 1,35 (ΧM)1/2 - 1,37
Båda XM som XP de är dimensionlösa värden; det vill säga de saknar enheter.
Skala av A.L. Allred och E. Rochow
Det finns andra elektronegativitetsskalor, såsom Sanderson- och Allen-skalorna. Den som följer de två första är dock Allred- och Rochow-skalan (χAR). Den här gången baseras den på den effektiva kärnladdning som en elektron upplever på ytan av atomer. Därför är det direkt relaterat till kärnans attraktiva styrka och skärmeffekten..
Hur varierar elektronegativiteten i det periodiska systemet?
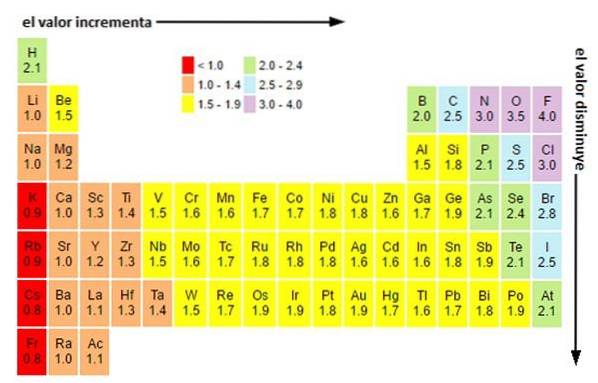
Oavsett skalor eller värden du har, ökar elektronegativiteten från höger till vänster under en period och från botten till toppen i grupperna. Således ökar den mot den övre högra diagonalen (räknas inte helium) tills den möter fluor.
På bilden ovan kan du se vad som just har sagts. I det periodiska systemet uttrycks Pauling-elektronegativiteterna som en funktion av cellernas färger. Eftersom fluor är det mest elektronegativa har det en mer framträdande lila färg, medan de minst elektronegativa (eller elektropositiva) mörkare färgerna..
På samma sätt kan det observeras att grupphuvudena (H, Be, B, C, etc.) har ljusare färger, och att när man kommer ner genom gruppen blir de andra elementen mörkare. Vad handlar det här om? Svaret är återigen både i egenskaperna EI, AE, Zef (effektiv kärnladdning) och i atomradien.
Atomen i molekylen
De enskilda atomerna har en riktig kärnladdning Z och de externa elektronerna lider av en effektiv kärnkraftsladdning till följd av skärmningseffekten..
När den rör sig över en period ökar Zef på ett sådant sätt att atomen kontraherar; det vill säga atomradierna reduceras över en period.
Detta har som konsekvens att elektronerna kommer att strömma mot atomen med den högsta Zef i ögonblicket av bindning av en atom med en annan. Detta ger också en jonisk karaktär till bindningen om det finns en markant tendens för elektroner att gå mot en atom. När detta inte är fallet talar vi om en övervägande kovalent bindning.
Av denna anledning varierar elektronegativiteten beroende på atomradierna, Zef, som i sin tur är nära besläktade med EI och AE. Allt är en kedja.
Vad är det för?
Vad är elektronegativitet för? I princip för att bestämma om en binär förening är kovalent eller jonisk. När elektronegativitetsskillnaden är mycket hög (med en hastighet av 1,7 enheter eller mer) sägs föreningen vara jonisk. Det är också användbart att urskilja i en struktur vilka regioner som sannolikt är rikare på elektroner..
Härifrån kan man förutsäga vilken mekanism eller reaktion föreningen kan genomgå. I elektronfattiga regioner, δ +, kan negativt laddade arter agera på ett visst sätt; och i elektronrika regioner kan deras atomer interagera på mycket specifika sätt med andra molekyler (dipol-dipolinteraktioner).
Exempel (klor, syre, natrium, fluor)
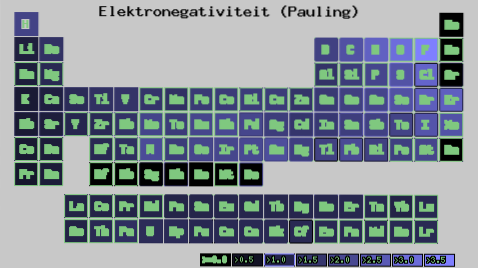
Vilka är elektronegativitetsvärdena för klor-, syre-, natrium- och fluoratomer? Vem är den mest elektronegativa efter fluor? Med hjälp av det periodiska systemet observeras att natrium har en mörklila färg, medan färgerna för syre och klor är mycket lika..
Dess elektronegativitetsvärden för Pauling-, Mulliken- och Allred-Rochow-skalorna är:
Na (0,93, 1,21, 1,01).
Eller (3.44, 3.22, 3.50).
Cl (3,16, 3,54, 2,83).
F (3,98, 4,43, 4,10).
Observera att med de numeriska värdena observeras en skillnad mellan negativa syre och klor.
Enligt Mulliken-skalan är klor mer elektronegativ än syre, i motsats till skalorna Pauling och Allred-Rochow. Elektronegativitetsskillnaden mellan de två elementen är ännu tydligare med Allred-Rochow-skalan. Och slutligen är fluor oavsett den valda skalan den mest elektronegativa..
Där det finns en F-atom i en molekyl betyder det därför att bindningen kommer att ha en hög jonisk karaktär..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan., Sidorna 30 och 44). Mc Graw Hill.
- Jim Clark. (2000). Elektronnegativitet. Hämtad från: chemguide.co.uk
- Anne Marie Helmenstine, Ph.D. (11 december 2017). Elektronegativitetsdefinition och exempel. Hämtad från: thoughtco.com
- Mark E. Tuckerman. (5 november 2011). Elektronegativitetsskala. Hämtad från: nyu.edu
- Wikipedia. (2018). Elektronnegativitet. Hämtad från: es.wikipedia.org



Ingen har kommenterat den här artikeln än.