
Sigma Link Hur det bildas, egenskaper och exempel
De sigma länk (representerad som σ) är en kovalent typförening, som kännetecknas av delningen av två elektroner som sker mellan ett par atomer för att bilda nämnda bindning. Dessutom är detta ett slags enkelbindning, där båda atomerna är fästa av två elektroner för att bilda en enda bindning..
När två eller flera atomer kombineras för att ge upphov till nya molekylära föreningar förenas de med hjälp av två typer av bindningar: joniska och kovalenta, vars struktur beror på hur elektronerna delas mellan båda atomerna som är involverade i denna koppling..
Förbindelsen som genereras genom elektronerna utförs tack vare överlappningen av orbitalerna som tillhör varje atom (vid sina ändar), och förstå som orbitaler de utrymmen där det är mest troligt att lokalisera elektronen i atomen och som definieras av elektron densitet.
Artikelindex
- 1 Hur bildas det??
- 1.1 Bildning av sigma-bindningar i olika kemiska arter
- 2 funktioner
- 3 Exempel
- 4 Referenser
Hur bildas det?
Vanligtvis är den enkla bindningen mellan två atomer känd för att vara ekvivalent med en enda sigma-bindning..
På samma sätt härrör dessa bindningar på grund av överlagringen eller överlappningen på ett frontalt sätt som uppstår mellan ändarna av atomorbitalerna i två olika atomer..
Dessa atomer vars orbitaler överlappar varandra måste ligga intill varandra så att de enskilda elektronerna som tillhör varje atombana effektivt kan binda och bilda bindningen..
Därav det faktum att den elektroniska fördelningen som manifesterar sig eller placeringen av elektronernas densitet från varje superposition har en cylindrisk symmetri runt axeln som uppstår mellan de två länkade atomarterna..
I detta fall kan den så kallade sigma-orbitalen lättare uttryckas i termer av intramolekylära bindningar som bildas i diatomiska molekyler, och noterar att det också finns flera typer av sigma-bindningar..
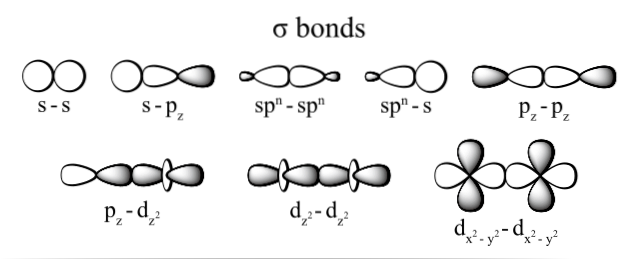
De vanligast observerade typerna av sigma-bindning är: dztvå+dztvå, s + pz, sidz+sidz och s + s; där abonnemanget z representerar axeln som bildas av den bildade bindningen och varje bokstav (s, p och d) motsvarar en orbital.
Bildning av sigma-bindningar i olika kemiska arter
När man talar om molekylära orbitaler hänvisas till de regioner som ackumulerar den högsta elektrontätheten när en bindning av denna typ bildas mellan olika molekyler, erhållen genom kombinationen av atomorbitaler..
Ur kvantmekanikens synvinkel har studier dragit slutsatsen att orbitaler av molekyltyp som uppvisar symmetriskt lika beteende faktiskt kombineras i blandningar (hybridiseringar).
Betydelsen av denna kombination av orbitaler är emellertid nära relaterad till de relativa energierna som manifesteras av orbitaler av molekyltyp som är symmetriskt lika..
När det gäller organiska molekyler observeras ofta cykliska arter som består av en eller flera ringstrukturer, vilka ofta utgörs av ett stort antal sigma-typbindningar i kombination med pi-typbindningar (multipla bindningar)..
Med hjälp av enkla matematiska beräkningar är det faktiskt möjligt att bestämma antalet sigma-bindningar som finns i en molekylär art..
Det finns också fall av koordineringsföreningar (med övergångsmetaller), där flera bindningar kombineras med olika klasser av bindningsinteraktioner, såväl som molekyler som består av olika typer av atomer (polyatomiska).
Egenskaper
Sigma-bindningar har unika egenskaper som tydligt skiljer dem från andra typer av kovalent bindning (pi-bindning), bland vilka är det faktum att denna typ av bindning är den starkaste bland de kovalenta klassiska kemiska bindningarna.
Detta beror på att överlappningen mellan orbitalerna sker direkt, koaxiellt (eller linjärt) och frontalt; det vill säga en maximal överlappning erhålls mellan orbitalerna.
Dessutom är den elektroniska fördelningen vid dessa korsningar huvudsakligen koncentrerad mellan kärnorna hos de atomarter som kombineras..
Denna överlappning av sigma-orbitaler sker på tre möjliga sätt: mellan ett par rena orbitaler (s-s), mellan en ren orbital och en hybrid-typ (s-sp) eller mellan ett par av hybrid-orbitaler (sp3- sp3).
Hybridisering sker tack vare blandningen av orbitaler av atomiskt ursprung av olika klasser, vilket ger att den resulterande hybridbana beror på mängden av var och en av typerna av rena utgående orbitaler (till exempel sp3 = en ren s orbital + tre rena p-typ orbitaler).
Utöver detta kan sigma-bindningen existera oberoende, såväl som medge fri rotationsrörelse mellan ett par atomer..
Exempel
Eftersom den kovalenta bindningen är den vanligaste typen av bindning mellan atomer, finns sigma-bindningen i ett stort antal kemiska arter, vilket kan ses nedan.
I diatomiska gasmolekyler - såsom väte (Htvå), syre (Otvåoch kväve (Ntvå) - olika typer av bindningar kan förekomma beroende på atomernas hybridisering.
När det gäller väte finns det en enda sigma-bindning som förbinder båda atomerna (H-H), eftersom varje atom bidrar med sin enda elektron.
Å andra sidan, i molekylärt syre är båda atomerna länkade med en dubbelbindning (O = O) - det vill säga en sigma-bindning - och en pi-bindning, vilket lämnar varje atom med tre par kvarvarande elektroner.
Istället har varje kväveatom fem elektroner i sin yttersta energinivå (valensskal), så de förenas av en trippelbindning (N≡N), vilket innebär närvaron av en sigma-bindning och två pi-bindningar och ett par parade elektroner i varje atom.
På samma sätt förekommer det i föreningar av cyklisk typ med enkel- eller multipelbindningar och i alla typer av molekyler vars struktur består av kovalenta bindningar..
Referenser
- Wikipedia. (s.f.). Sigma bond. Återställd från en.wikipedia.org
- Chang, R. (2007). Chemistry, nionde upplagan. Mexiko: McGraw-Hill.
- ThoughtCo. (s.f.). Definition av Sigma Bond Chemistry. Återställd från thoughtco.com
- Britannica, E. (s.f.). Sigma bond. Hämtad från britannica.com
- LibreTexts. (s.f.). Sigma och Pi-obligationer. Återställd från chem.libretexts.org
- Srivastava, A. K. (2008). Organisk kemi gjort enkel. Återställd från books.google.co.ve



Ingen har kommenterat den här artikeln än.