
Ester Bond-egenskaper och -typer

A esterbindning definieras som bindningen mellan en alkoholgrupp (-OH) och en karboxylsyragrupp (-COOH), bildad genom eliminering av en vattenmolekyl (H ^).tvåO) (Futura-Sciences ,, S.F.).
Strukturen för etylacetat visas i figur 1. Esterbindningen är den enda bindningen som bildas mellan karboxylsyrans syre och kolet i etanol.

R-COOH + R'-OH → R-COO-R '+ HtvåELLER
I figuren motsvarar den blå delen den del av föreningen som kommer från etanol och den gula delen motsvarar ättiksyra. Esterbindningen är markerad i den röda cirkeln.
Artikelindex
- 1 Hydrolys av esterbindningen
- 2 Typer av ester
- 2.1 Kolester
- 2.2 Fosforsyraester
- 2.3 Svavelester
- 3 Referenser
Hydrolys av esterbindningen
För att förstå lite bättre arten av esterbindningarna förklaras reaktionsmekanismen för hydrolysen av dessa föreningar. Esterbindningen är relativt svag. I surt eller basiskt medium hydrolyseras det till att bilda alkohol respektive karboxylsyra. Reaktionsmekanismen för hydrolys av estrar är väl studerad.
I basmedium attackerar nukleofila hydroxider först vid den elektrofila C i C = O-estern, bryter π-bindningen och skapar den tetraedriska mellanprodukten.
Mellanprodukten kollapsar sedan och reformerar C = O, vilket resulterar i förlusten av den lämnande gruppen, alkoxiden, RO-, vilket leder till karboxylsyran..
Slutligen är en syra / basreaktion en mycket snabb jämvikt där alkoxiden, RO- fungerar som en bas som deprotoniserar karboxylsyran, RCO2H, (en syrabehandling skulle göra det möjligt att erhålla karboxylsyran från reaktionen).

Mekanismen för hydrolys av esterbindningen i ett surt medium är lite mer komplicerat. En syra / basreaktion inträffar först, eftersom du bara har en svag nukleofil och en dålig elektrofil måste du aktivera estern.
Protonering av karbonylestern gör den mer elektrofil. I det andra steget fungerar syret i vattnet som nukleofilen genom att attackera den elektrofila C i C = O, med elektronerna rör sig mot hydroniumjonen, vilket skapar den tetrahedriska mellanprodukten..
I det tredje steget inträffar en syra / basreaktion, som tar bort syret som kommer från vattenmolekylen för att neutralisera laddningen..
I det fjärde steget inträffar ytterligare en syra / basreaktion. Du måste få ut -OCH3, men du måste göra den till en bra lämnande grupp genom protonation.
I det femte steget använder de elektroner från ett intilliggande syre för att hjälpa till att "skjuta ut" den lämnande gruppen, vilket ger en neutral alkoholmolekyl..
I det sista steget inträffar en syra / basreaktion. Avrotering av hydroniumjonen avslöjar C = O-karbonylen i karboxylsyraprodukten och regenererar syrakatalysatorn (Dr. Ian Hunt, S.F.).
Ester-typer
Kolester
Kolsyraestrar är de vanligaste av denna typ av förening. Den första kolestern var etylacetat eller även kallad etyletanoat. Tidigare var denna förening känd som vinägereter, vars namn på tyska är Essig-Äther vars sammandragning härstammar från namnet på denna typ av förening.
Estrar finns i naturen och används ofta i industrin. Många estrar har karakteristiska fruktluktar, och många finns naturligt i eteriska oljor från växter. Detta har också lett till dess vanliga användning i konstgjorda dofter och dofter när dofter försöker imiteras..
Flera miljarder kilo polyestrar produceras årligen industriellt, viktiga produkter som de är; polyetylentereftalat, akrylatestrar och cellulosaacetat.
Esterbindningen av karboxylestrar är ansvarig för bildandet av triglycerider i levande organismer.
Triglycerider finns i alla celler, men huvudsakligen i fettvävnad, de är den huvudsakliga energireserven som kroppen har. Triacylglycerider (TAG) är glycerolmolekyler kopplade till tre fettsyror genom en esterbindning. De fettsyror som finns i TAG är övervägande mättade (Wilkosz, 2013).
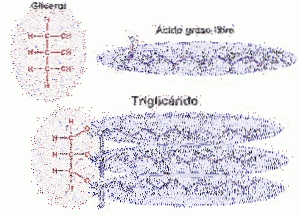
Triacylglycerider (triglycerider) syntetiseras i praktiskt taget alla celler. De viktigaste vävnaderna för syntesen av TAG är tunntarmen, levern och adipocyterna. Förutom tarmarna och adipocyterna börjar TAG-syntesen med glycerol.
Glycerol fosforyleras först med glycerolkinas och sedan aktiveras fettsyror (fettacyl-CoA) som substrat för tillsatsen av fosfatid-syra-alstrande fettsyror. Fosfatgruppen avlägsnas och den sista fettsyran tillsätts.
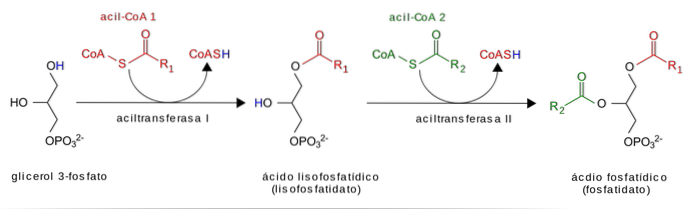
I tunntarmen hydrolyseras diet-TAG-er för att frigöra fettsyror och monoacylglycerider (MAG) före intag av enterocyter. Enterocyt-MAG: er fungerar som substrat för acylering i en tvåstegsprocess som producerar en TAG.
Inom fettvävnad finns inget uttryck av glycerolkinas så byggstenen för TAG i denna vävnad är den glykolytiska mellanprodukten, dihydroxiacetonfosfat, DHAP.
DHAP reduceras till glycerol-3-fosfat av cytosolisk glycerol-3-fosfatdehydrogenas och den återstående TAG-syntesreaktionen är densamma som för alla andra vävnader.
Fosforsyraester
Fosforsyraestrar produceras genom bildandet av en esterbindning mellan en alkohol och fosforsyra. Med tanke på syrastrukturen kan dessa estrar vara mono, di och trisubstituerade.
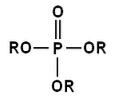
Dessa typer av esterbindningar finns i föreningar såsom fosfolipider, ATP, DNA och RNA..
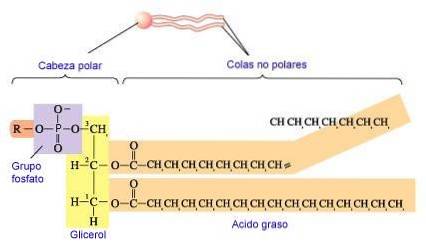
Fosfolipider syntetiseras genom bildandet av en esterbindning mellan en alkohol och fosfatidinsyrafosfat (1,2-diacylglycerol-3-fosfat). De flesta fosfolipider har en mättad fettsyra på C-1 och en omättad fettsyra på C-2 i glycerolskelettet.
De vanligast tillsatta alkoholerna (serin, etanolamin och kolin) innehåller också kväve som kan laddas positivt, medan glycerol och inositol inte gör det (King, 2017).
Adenosintrifosfat (ATP) är en molekyl som används som energivaluta i cellen. Denna molekyl består av en adeninmolekyl kopplad till ribosmolekylen med tre fosfatgrupper (figur 8).
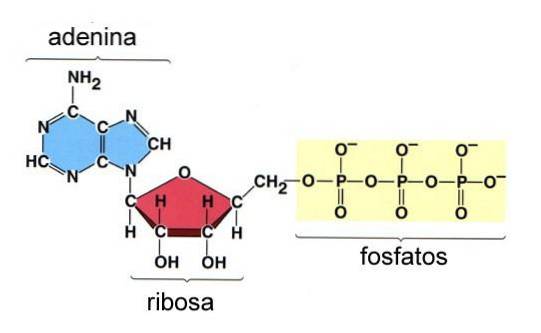
De tre fosfatgrupperna i molekylen kallas gamma (γ), beta (β) och Alpha (α), den senare förestrar C-5-hydroxylgruppen i ribos.
Bindningen mellan ribos och a-fosforylgruppen är en fosfoesterbindning eftersom den innefattar en kolatom och en fosforatom, medan β- och γ-fosforylgrupperna i ATP är förbundna med fosfoanhydridbindningar som inte involverar kolatomer..
All fosfoanhydro har avsevärd kemisk potentiell energi och ATP är inget undantag. Denna potentiella energi kan användas direkt i biokemiska reaktioner (ATP, 2011).
En fosfodiesterbindning är en kovalent bindning i vilken en fosfatgrupp är bunden till intilliggande kol genom esterbindningar. Bindningen är resultatet av en kondensationsreaktion mellan en hydroxylgrupp med två sockergrupper och en fosfatgrupp.
Diesterbindningen mellan fosforsyra och två sockermolekyler i DNA och ryggrad RNA förbinder två nukleotider tillsammans för att bilda oligonukleotidpolymerer. Fosfodiesterbindningen kopplar ett 3'-kol till ett 5'-kol i DNA och RNA.
(bas1) - (ribos) -OH + HO-P (O) 2-0- (ribos) - (bas 2)
(bas1) - (ribos) - O - P (O) 2 - O- (ribos) - (bas 2) + HtvåELLER
Under reaktionen mellan två av hydroxylgrupperna i fosforsyra och en hydroxylgrupp i två andra molekyler bildas två esterbindningar i en fosfodiestergrupp. En kondensationsreaktion där en vattenmolekyl går förlorad genererar varje esterbindning.
Under polymerisationen av nukleotider för att bilda nukleinsyror, fäster hydroxylgruppen i fosfatgruppen till 3'-kolet i ett socker av en nukleotid för att bilda en esterbindning till fosfatet i en annan nukleotid.
Reaktionen bildar en fosfodiesterbindning och avlägsnar en vattenmolekyl (fosfodiesther bond formation, S.F.).
Svavelester
Svavelestrar eller tioestrar är föreningar med den funktionella gruppen R-S-CO-R '. De är produkten av förestringen mellan en karboxylsyra och en tiol eller med svavelsyra (Block, 2016).
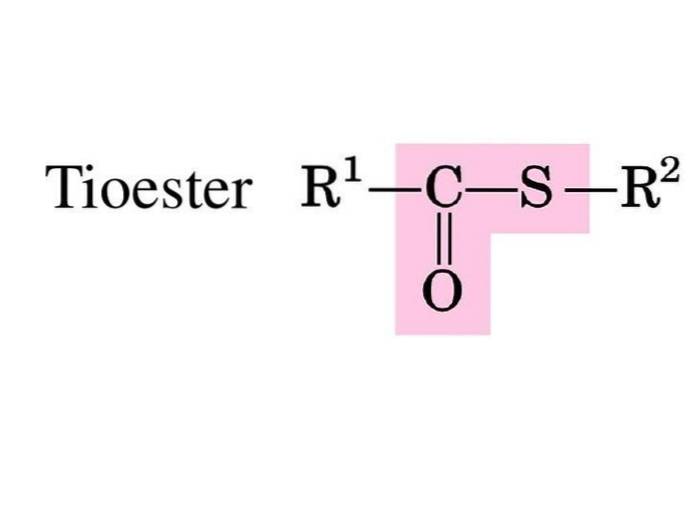
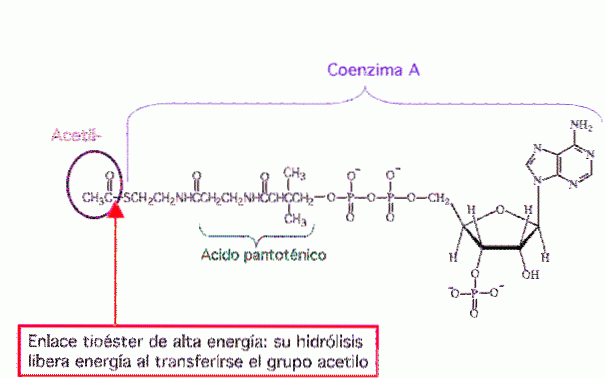
I biokemi är de mest kända tioestrarna derivat av koenzym A, till exempel acetyl-CoA.
Acetylkoenzym A eller acetyl-CoA (figur 8) är en molekyl som deltar i många biokemiska reaktioner. Det är en central molekyl i metabolismen av lipider, proteiner och kolhydrater.
Dess huvudsakliga funktion är att leverera acetylgruppen till citronsyracykeln (Krebs-cykeln) som ska oxideras för energiproduktion. Det är också föregångarmolekylen för syntes av fettsyror och är en produkt av nedbrytningen av vissa aminosyror.
De ovan nämnda CoA-aktiverade fettsyrorna är andra exempel på tioestrar med ursprung i muskelcellen. Oxidationen av fettsyra-CoA-tioestrar sker faktiskt i diskreta vesikulära kroppar som kallas mitokondrier (Thompson, 2015).
Referenser
- ATP. (2011, 10 augusti). Återställd från learningbiochemistry.wordpress: learnbiochemistry.wordpress.com.
- Block, E. (2016, 22 april). Organosvavelförening. Hämtad från britannica: britannica.com.
- Ian Hunt. (S.F.). Hydrolys av estrar. Återställd från chem.ucalgary.ca: chem.ucalgary.ca.
- Futura-Sciences,. (S.F.). Ester bond. Återställd från futura-sciences.us.
- King, M. W. (2017, 16 mars). Fettsyra, triglycerider och fosfolipidsyntes och metabolism. Återställd från themedicalbiochemistrypage.org.
- bildning av fosfodiestherbindning. (S.F.). Återställd från biosyn: biosyn.com.
- Thompson, T. E. (2015, 19 augusti). Lipid. Återställd från britannica: britannica.com.
- Wilkosz, R. (2013, 6 november). Bildandet av esterbindningar i syntesen av lipider. Återställd från wisc-online.com.


Ingen har kommenterat den här artikeln än.