
Cyklopentan (C5H10) struktur, egenskaper och användningsområden
De cyklopentan det är ett cykliskt kolväte, specifikt en cykloalkan. I sin tur är det en organisk förening vars molekylformel är C5H10. Det kan ses som den slutna versionen av n-pentan, öppen kedja, i vilken dess ändar har förenats av förlusten av två väteatomer.
Den nedre bilden visar skelettet av cyklopentan. Lägg märke till hur geometriskt dess skelett ser ut och bilda en femkantig ring. Emellertid är dess molekylära struktur inte platt utan presenterar veck som försöker stabilisera och minska spänningen i ringen. Cyklopentan är en mycket flyktig och brandfarlig vätska, men inte så brandfarlig som n-pentan.
På grund av dess lösningsmedelskapacitet är cyklopentan ett av de mest använda lösningsmedlen i den kemiska industrin. Det är inte förvånande att många produkter med stark lukt innehåller det bland deras sammansättning, varför de är brandfarliga. Det används också som ett jäsmedel för polyuretanskum som används i kylskåp..
Artikelindex
- 1 Struktur av cyklipentan
- 1.1 Intermolekylära interaktioner
- 1.2 Konstruktioner och ringspänning
- 2 Egenskaper hos cyklipentan
- 2.1 Fysiskt utseende
- 2.2 Molmassa
- 2.3 Smältpunkt
- 2.4 Kokpunkt
- 2.5 Flampunkt
- 2.6 Självantändningstemperatur
- 2.7 Förångningsvärme
- 2.8 Viskositet
- 2.9 Brytningsindex
- 2.10 Ångtryck
- 2.11 Densitet
- 2.12 Löslighet
- 2.13 Fördelningskoefficient oktanol / vatten
- 2.14 Reaktivitet
- 3 användningsområden
- 3.1 Industriellt lösningsmedel
- 3.2 Etylenkälla
- 3.3 Isolerande polyuretanskum
- 4 Referenser
Struktur av cyklipentan
Intermolekylära interaktioner
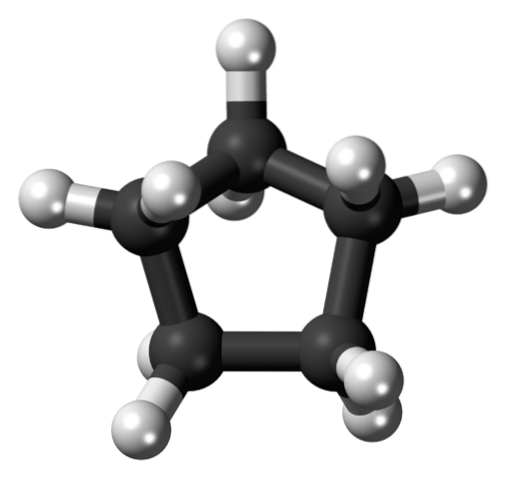
I den första bilden visades cyklopentanskelettet. Ovan ser vi nu att det är mer än en enkel femkant: väteatomer (vita sfärer) sticker ut vid dess kanter, medan kolatomer utgör den femkantiga ringen (svarta sfärer).
Genom att endast ha C-C och C-H-bindningar är deras dipolmoment försumbar, så cyklopentanmolekyler kan inte interagera med varandra genom dipol-dipolkrafter. Istället hålls de tillsammans tack vare Londons spridande krafter, med ringarna som försöker stapla ovanpå varandra..
Denna stapling erbjuder en viss kontaktyta större än den som är tillgänglig mellan linjära molekyler av n-pentan. Som ett resultat av detta har cyklopentan en högre kokpunkt än n-pentan, liksom ett lägre ångtryck.
Dispergeringskrafter är ansvariga för att cyklopentan bildar en molekylär kristall när den fryses vid -94 ° C. Även om det inte finns mycket information om dess kristallina struktur är den polymorf och har tre faser: I, II och III, med fas II som en orolig blandning av I och III.
Konstruktioner och ringspänning
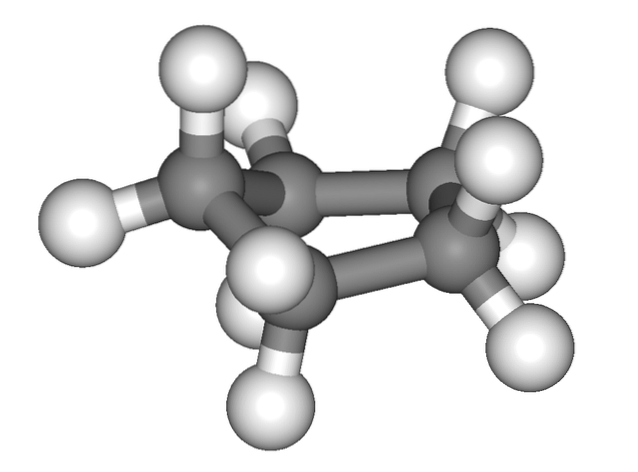
Bilden ovan ger ett felaktigt intryck av att cyklopentan är platt; men det är inte så. Alla dess kolatomer har sp-hybridisering3, så deras orbitaler är inte i samma plan. Dessutom, som om detta inte var tillräckligt, är väteatomerna mycket nära varandra, kraftigt avstötade när de förmörkas..
Således talar vi om konformationer, en av dem är halvstolen (översta bilden). Ur detta perspektiv inses det tydligt att cyklopentanringen har böjningar, vilket hjälper till att minska dess ringspänning på grund av dess kolatomer så nära varandra..
Denna spänning beror på det faktum att C-C-bindningarna uppvisar vinklar som är mindre än 109,5 °, det ideala värdet för den tetraedriska miljön som ett resultat av deras sp-hybridiseringar.3.
Trots denna stress är emellertid cyklopentan en mer stabil och mindre brandfarlig förening än pentan. Detta kan verifieras genom att jämföra deras säkerhetsdiamanter, i vilka cyklopentans antändlighet är 3, medan den för pentan, 4.
Egenskaper hos cyklipentan
Fysiskt utseende
Färglös vätska med en mild petroleumliknande lukt.
Molmassa
70,1 g / mol
Smältpunkt
-93,9 ºC
Kokpunkt
49,2 ºC
Flampunkt
-37,2 ºC
Självantändningstemperatur
361 ºC
Förångningsvärme
28,52 kJ / mol vid 25 ºC
Viskositet
0,413 mPa s
Brytningsindex
1,4065
Ångtryck
45 kPa vid 20 ° C Detta tryck motsvarar cirka 440 atm, dock lägre än det för n-Pentan: 57,90 kPa.
Här manifesteras effekten av strukturen: cyklopentanringen tillåter effektivare intermolekylära interaktioner, som binder och behåller mer sina molekyler i vätskan jämfört med de linjära molekylerna i n-pentan. Därför har den senare ett högre ångtryck.
Densitet
0,751 g / cm3 vid 20 ° C. Å andra sidan är dess ångor 2,42 gånger tätare än luft.
Löslighet
I en liter vatten vid 25 ° C löses endast 156 mg cyklopentan på grund av dess hydrofoba natur. Det är emellertid blandbart i icke-polära lösningsmedel såsom andra paraffiner, etrar, bensen, koltetraklorid, aceton och etanol..
Fördelningskoefficient oktanol / vatten
3
Reaktivitet
Cyklopentan är stabilt när det lagras ordentligt. Det är inte en reaktiv substans eftersom dess C-H- och C-C-bindningar inte är lätta att bryta, även om det skulle leda till frigöring av energi orsakad av ringens spänning.
I närvaro av syre kommer det att brinna i en förbränningsreaktion, vare sig det är fullständigt eller ofullständigt. Eftersom cyklopentan är en mycket flyktig förening måste den förvaras på platser där den inte kan utsättas för någon värmekälla..
Under tiden, i frånvaro av syre, kommer cyklopentan att genomgå en pyrolysreaktion och sönderdelas i mindre och omättade molekyler. En av dem är 1-penten, vilket visar att värme bryter cyklopentanringen för att producera en alken.
Å andra sidan kan cyklopentan reagera med brom under ultraviolett strålning. På detta sätt ersätts en av dess C-H-obligationer med C-Br, som i sin tur kan ersättas av andra grupper; och således växer cyklopentanderivat fram.
Applikationer
Industriellt lösningsmedel
Den hydrofoba och apolära karaktären hos cyklopentan gör det till ett avfettande lösningsmedel tillsammans med andra paraffiniska lösningsmedel. På grund av detta är det vanligtvis en del av formuleringarna av många produkter, såsom lim, syntetiska hartser, färger, lim, tobak och bensin..
Etylenkälla
När cyklopentan utsätts för pyrolys är ett av de viktigaste ämnena det genererar eten, som har otaliga tillämpningar i polymervärlden..
Isolerande polyuretanskum
En av de mest anmärkningsvärda användningarna av cyklopentan är som ett jäsmedel för tillverkning av isolerande polyuretanskum; dvs cyklopentanångor, på grund av deras höga tryck, expanderar det polymera materialet tills det bildar ett skum med fördelaktiga egenskaper som kan användas i ramen för kylskåp eller frysar.
Vissa företag har valt att ersätta cyklopentan med HFC vid tillverkning av isoleringsmaterial, eftersom det inte bidrar till att ozonskiktet försämras och också minskar utsläppet av växthusgaser i miljön..
Referenser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. (10th utgåva.). Wiley plus.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Wikipedia. (2020). Cyklopentan. Återställd från: en.wikipedia.org
- Nationellt centrum för bioteknikinformation. (2020). Cyklopentan. PubChem-databas, CID = 9253. Återställd från: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Cyklopentan. ScienceDirect. Återställd från: sciencedirect.com
- GE apparater. (2011, 11 januari). Minska växthusgasutsläppen vid GE: s kyltillverkningsanläggningar. Återställd från: pressroom.geappliances.com



Ingen har kommenterat den här artikeln än.