
Interatomiska länkar egenskaper och typer

De länk interatomär Det är den kemiska bindningen som bildas mellan atomer för att producera molekyler. Även om forskare idag i allmänhet är överens om att elektroner inte kretsar kring kärnan, trodde man genom historien att varje elektron kretsade kring atomens kärna i ett separat skal..
Idag har forskare kommit fram till att elektroner svävar över specifika delar av atomen och inte bildar banor, men valensskalet används fortfarande för att beskriva tillgängligheten av elektroner..
Linus Pauling bidrog till den moderna förståelsen av kemisk bindning genom att skriva boken "The Nature of Chemical Bonding" där han samlade idéer från Sir Isaac Newton, Étienne François Geoffroy, Edward Frankland och i synnerhet Gilbert N. Lewis.
I det kopplade han kvantmekanikens fysik med den kemiska naturen hos de elektroniska interaktioner som uppstår när kemiska bindningar görs..
Paulings arbete fokuserade på att fastställa att sanna jonbindningar och kovalenta bindningar ligger i ändarna av ett bindningsspektrum, och att de flesta kemiska bindningar klassificeras mellan dessa ytterligheter..
Pauling utvecklade vidare en glidskala av bindningstyp som styrs av elektronegativiteten hos de atomer som är involverade i bindningen..
Paulings enorma bidrag till vår moderna förståelse av kemisk bindning ledde till att han tilldelades Nobelpriset 1954 för "undersökning av kemisk bindning och dess tillämpning för att klargöra strukturen hos komplexa ämnen."
Levande saker består av atomer, men i de flesta fall flyter dessa atomer inte bara individuellt. Istället interagerar de normalt med andra atomer (eller grupper av atomer).
Exempelvis kan atomer anslutas med starka bindningar och organiseras i molekyler eller kristaller. Eller så kan de bilda tillfälliga, svaga bindningar med andra atomer som kolliderar med dem..
Både de starka bindningarna som binder molekyler och de svaga bindningarna som skapar tillfälliga kopplingar är väsentliga för kemin i våra kroppar och för själva livet..
Atomer tenderar att ordna sig i så stabila mönster som möjligt, vilket innebär att de har en tendens att slutföra eller fylla sina yttersta elektronbanor..
De förbinder sig med andra atomer för att göra just det. Kraften som håller atomer samman i samlingar som kallas molekyler är känd som en kemisk bindning..
Typer av interatomiska kemiska bindningar
Metallisk bindning
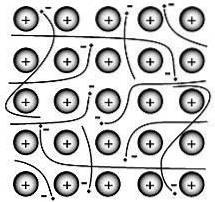
Metallbindningen är den kraft som håller atomerna samman i en ren metallisk substans. En sådan fast substans består av tätt packade atomer.
I de flesta fall överlappar det yttersta elektronskalet hos var och en av metallatomerna med ett stort antal angränsande atomer. Som en konsekvens rör sig valenselektroner kontinuerligt från atom till atom och är inte associerade med något specifikt par atomer..
Metaller har flera kvaliteter som är unika, såsom förmågan att leda elektricitet, låg joniseringsenergi och låg elektronegativitet (så att de enkelt ger upp elektroner, det vill säga de är katjoner)..
Deras fysiska egenskaper inkluderar ett glänsande (glänsande) utseende, och de är smidiga och duktila. Metaller har en kristallstruktur. Metaller är emellertid också formbara och duktila.
På 1900-talet kom Paul Drüde fram till elektronhavsteorin genom att modellera metaller som en blandning av atomkärnor (atomkärnor = positiva kärnor + inre elektronskal) och valenselektroner..
I denna modell är valenselektronerna fria, avlokaliserade, mobila och inte associerade med någon speciell atom..
Joniskt band
Joniska bindningar är elektrostatiska. De uppstår när ett element med en positiv laddning förenar ett med en negativ laddning genom coulombiska interaktioner.
Element med låg joniseringsenergi har en tendens att lätt förlora elektroner medan element med hög elektronaffinitet har en tendens att få dem att producera katjoner respektive anjoner, vilket är det som bildar jonbindningar..
Föreningar som visar jonbindningar bildar joniska kristaller i vilka positiva och negativt laddade joner svänger nära varandra, men det finns inte alltid en direkt 1-1 korrelation mellan positiva och negativa joner..
Joniska bindningar kan vanligtvis brytas genom hydrering eller tillsats av vatten till en förening.
Ämnen som hålls samman av jonbindningar (såsom natriumklorid) kan vanligtvis separeras i riktigt laddade joner när de påverkas av en yttre kraft, såsom när de löses i vatten..
Dessutom, i fast form, lockas enskilda atomer inte till en enskild granne utan bildar istället jätte nätverk som lockas till varandra genom elektrostatiska interaktioner mellan kärnan i varje atom och närliggande valenselektroner..
Attraktionskraften mellan angränsande atomer ger joniska fasta ämnen en extremt ordnad struktur känd som ett joniskt galler, där motsatt laddade partiklar inriktas med varandra för att skapa en tätt bunden styv struktur..

Kovalent bindning
Kovalent bindning uppstår när par av elektroner delas av atomer. Atomerna kommer att sammanfoga kovalent med andra atomer för att få mer stabilitet, vilket erhålls genom att bilda ett komplett elektronskal.
Genom att dela sina yttersta (valens) elektroner kan atomer fylla deras yttre skal med elektroner och få stabilitet..
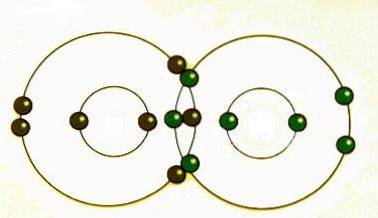
Även om atomer sägs dela elektroner när de bildar kovalenta bindningar, delar de ofta inte elektroner lika. Först när två atomer av samma element bildar en kovalent bindning delas de delade elektronerna faktiskt lika mellan atomerna..
När atomer med olika element delar elektroner genom kovalent bindning dras elektronen vidare mot atomen med den högsta elektronegativiteten vilket resulterar i en polär kovalent bindning..
Jämfört med jonföreningar har kovalenta föreningar vanligtvis en lägre smält- och kokpunkt och är mindre benägna att lösa sig i vatten..
Kovalenta föreningar kan vara i gas, flytande eller fast tillstånd och leder inte elektricitet eller värmer bra..
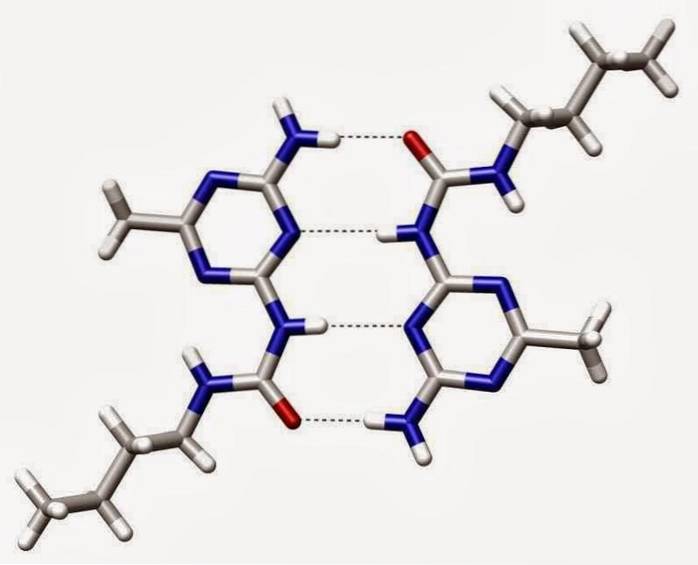
Vätebindningar
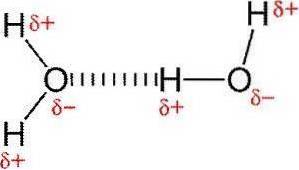
Vätebindningar eller vätebindningar är svaga interaktioner mellan en väteatom fäst vid ett elektronegativt element med ett annat elektronegativt element.
I en polär kovalent bindning som innehåller väte (till exempel en O-H-bindning i en vattenmolekyl) kommer väte att ha en liten positiv laddning eftersom bindningselektronerna dras starkare mot det andra elementet..
På grund av denna lilla positiva laddning kommer väte att lockas till alla angränsande negativa laddningar..
Länkar till Van der Waals
De är relativt svaga elektriska krafter som lockar neutrala molekyler till varandra i gaser, i flytande och stelnade gaser och i nästan alla organiska och fasta vätskor..
Krafterna är uppkallade efter den holländska fysikern Johannes Diderik van der Waals, som 1873 först postulerade dessa intermolekylära krafter för att utveckla en teori för att förklara egenskaperna hos verkliga gaser..
Van der Waals-krafter är en allmän term som används för att definiera attraktionen av intermolekylära krafter mellan molekyler..
Det finns två klasser av Van der Waals-krafter: Londons spridningskrafter som är svaga och starkare dipol-dipolkrafter..
Referenser
- Anthony Capri, A. D. (2003). Kemisk bindning: Kemisk bindning. Hämtad från visionlearning visionlearning.com
- Camy Fung, N. M. (2015, 11 augusti). Kovalenta obligationer. Hämtad från chem.libretexts chem.libretexts.org
- Clark, J. (2017, 25 februari). Metallisk bindning. Hämtad från chem.libretexts chem.libretexts.org
- Encyclopædia Britannica. (2016, 4 april). Metallisk bindning. Hämtad från britannica britannica.com.
- Encyclopædia Britannica. (2016, 16 mars). Van der Waals styrkor. Hämtad från britannica britannica.com
- Kathryn Rashe, L. P. (2017, 11 mars). Van der waals styrkor. Hämtad från chem.libretexts chem.libretexts.org.
- Khan, S. (S.F.). Kemiska bindningar. Hämtad från khanacademy khanacademy.org.
- Martinez, E. (2017, 24 april). Vad är Atomic Bonding? Hämtad från sciencing sciencing.com.
- Wyzant, Inc. (S.F.). Obligationer. Hämtad från wyzant wyzant.com.



Ingen har kommenterat den här artikeln än.