
Halvledaregenskaper, egenskaper, typer, exempel

De fast tillstånd det är ett av de viktigaste sätten på vilka materia tillsätts för att skapa kondenserade eller fasta kroppar. Hela jordskorpan, som utelämnar hav och hav, är ett brokigt konglomerat av fasta ämnen. Exempel på föremål i fast tillstånd är en bok, en sten eller sandkorn.
Vi kan interagera med fasta ämnen tack vare avstötningen från våra elektroner med deras atomer eller molekyler. Till skillnad från vätskor och gaser, så länge de inte är allvarligt giftiga, kan våra händer inte gå igenom dem utan smula eller absorbera dem.

Fastämnen är i allmänhet mycket lättare att hantera eller lagra än en vätska eller en gas. Om inte partiklarna är finfördelade kommer en vindström inte att bära den i andra riktningar; är fixerade i det utrymme som definieras av intermolekylära interaktioner mellan deras atomer, joner eller molekyler.
Artikelindex
- 1 Begreppet fast
- 2 Allmänna egenskaper hos fasta ämnen
- 3 fastigheter
- 3.1 Smältpunkter
- 3.2 Stökiometri
- 3.3 Fel
- 3.4 Reaktivitet
- 3.5 Fysisk
- 4 Typer och exempel
- 4.1 Kristallina fasta ämnen
- 4.2 Amorfa fasta ämnen
- 4.3 Jonisk
- 4.4 Metallisk
- 4.5 Atomic
- 4.6 Molekylär och polymer
- 4.7 Kovalenta nätverk
- 5 Referenser
Fast koncept
Det fasta ämnet är ett tillstånd av materia där det finns en styv volym och form; partiklarna som bildar material eller föremål i fast tillstånd är fixerade på ett ställe, de är inte lätt komprimerbara.
Detta tillstånd av materia är det mest varierande och rika när det gäller kemi och fysik. Vi har joniska, metalliska, atomära, molekylära och kovalenta fasta ämnen, var och en med sin egen strukturella enhet; det vill säga med sina egna kristaller. När deras aggregeringssätt inte tillåter dem att etablera ordnade interna strukturer blir de amorfa och invecklade.
Studien av solid state konvergerar i design och syntes av nya material. Till exempel har trä, ett naturligt fast ämne, också använts som prydnadsmaterial och för byggande av hus.
Andra fasta material tillåter tillverkning av bilar, flygplan, fartyg, rymdskepp, kärnreaktorer, sportartiklar, batterier, katalysatorer och många andra föremål eller produkter..
Allmänna egenskaper hos fasta ämnen

De viktigaste egenskaperna hos fasta ämnen är:
-De har bestämd massa, volym och former. En gas har till exempel inte ett slut eller en början, eftersom dessa beror på behållaren som lagrar den..
-De är väldigt täta. Torrsubstanser tenderar att vara tätare än vätskor och gaser; även om det finns några undantag från regeln, särskilt när man jämför vätskor och fasta ämnen.
-Avstånden som skiljer deras partiklar är korta. Detta innebär att de har varit mycket sammanhängande eller komprimerade i sin respektive volym.

-Deras intermolekylära interaktioner är mycket starka, annars skulle de inte existera som sådana och smälta eller sublimera under markbundna förhållanden..

-Mobiliteten hos fasta ämnen är vanligtvis ganska begränsad, inte bara ur materiell synvinkel utan också ur molekylär synvinkel. Dess partiklar är begränsade i ett fast läge, där de bara kan vibrera, men inte röra sig eller rotera (i teorin).
Egenskaper
Smältpunkter
Alla fasta ämnen, såvida de inte sönderdelas under processen, och oavsett om de är bra värmeledare eller inte, kan passera i flytande tillstånd vid en viss temperatur: deras smältpunkt. När denna temperatur har uppnåtts lyckas dess partiklar äntligen att flyta och fly från sina fasta positioner..
Denna smältpunkt beror på det fasta ämnets natur, dess interaktioner, molmassan och den kristallina gitterenergin. Som en allmän regel tenderar joniska fasta ämnen och kovalenta nätverk (såsom diamant och kiseldioxid) att ha de högsta smältpunkterna; medan molekylära fasta ämnen, det lägsta.
Följande bild visar hur en isbit (fast tillstånd) förvandlas till flytande tillstånd:

Stökiometri
Mycket av de fasta ämnena är molekylära, eftersom de är föreningar vars intermolekylära interaktioner gör att de kan sammanföras på ett sådant sätt. Men många andra är joniska eller delvis joniska, så deras enheter är inte molekyler utan celler: en uppsättning atomer eller joner ordnade på ett ordnat sätt..
Det är här formlerna för sådana fasta ämnen måste respektera laddningernas neutralitet, vilket indikerar deras sammansättning och stökiometriska förhållanden. Till exempel den fasta substans vars hypotetiska formel är AtvåB4ELLERtvå påpekar att den har samma antal A-atomer som O (2: 2), medan den har dubbelt så många B-atomer (2: 4).
Observera att prenumerationerna med formel AtvåB4ELLERtvå de är heltal, vilket visar att det är ett stökiometriskt fast ämne. Sammansättningen av många fasta ämnen beskrivs av dessa formler. Avgifterna för A, B och O måste lägga till lika med noll, för annars skulle det finnas en positiv eller negativ laddning.
För fasta ämnen är det särskilt användbart att veta hur man tolkar deras formler, eftersom sammansättningen av vätskor och gaser i allmänhet är enklare.
Fel
De fasta strukturerna är inte perfekta; de uppvisar brister eller defekter, hur kristallina de än är. Detta är inte fallet med vätskor eller gaser. Det finns inga regioner med flytande vatten som kan bekräftas i förväg som "förskjuts" med avseende på sin omgivning..
Sådana defekter är ansvariga för att de fasta ämnena är hårda och spröda, uppvisande egenskaper såsom pyroelektricitet och piezoelektricitet, eller upphör att ha definierade kompositioner; det vill säga de är icke-stökiometriska fasta ämnen (till exempel A0,4B1.3ELLER0,5).
Reaktivitet
Fastämnen är vanligtvis mindre reaktiva än vätskor och gaser; men inte på grund av kemiska orsaker, utan på det faktum att deras strukturer hindrar reaktanter från att attackera partiklarna inuti dem och reagera först med de på deras yta. Därför tenderar reaktioner som involverar fasta ämnen att vara långsammare; såvida de inte är pulveriserade.
När ett fast ämne är i pulverform har dess mindre partiklar en större yta eller yta att reagera. Det är därför som fina fasta ämnen ofta märks som potentiellt farliga reagens, eftersom de kan antändas snabbt eller reagera kraftigt i kontakt med andra ämnen eller föreningar..
Torrsubstanser löses ofta i ett reaktionsmedium för att homogenisera systemet och genomföra en syntes med högre utbyte..
Fysisk
Med undantag för smältpunkten och defekterna motsvarar det som hittills har sagts mer de fasta kemiska egenskaperna än deras fysiska egenskaper. Materialfysiken är djupt fokuserad på hur ljus, ljud, elektroner och värme interagerar med fasta ämnen, oavsett om de är kristallina, amorfa, molekylära etc..
Det är här det som kallas plast, elastiskt, styvt, ogenomskinligt, transparent, supraledande, fotoelektriskt, mikroporöst, ferromagnetiskt, isolerande eller halvledarfast material..
I kemi är till exempel material som inte absorberar ultraviolett strålning eller synligt ljus av intresse, eftersom de används för att göra mätceller för UV-Vis-spektrofotometrar. Detsamma händer med infraröd strålning, när du vill karakterisera en förening genom att erhålla dess IR-spektrum eller studera hur reaktionen fortskrider.
Studie och manipulation av alla fysiska egenskaper hos fasta ämnen kräver enormt engagemang, liksom deras syntes och design, och väljer "bitar" av oorganisk, biologisk, organisk eller organometallisk konstruktion för nya material.
Typer och exempel
Eftersom det finns flera typer av fasta ämnen kemiskt kommer representativa exempel att nämnas separat för var och en..
Kristallina fasta ämnen
Å ena sidan finns det kristallina fasta ämnen. Dessa element karaktäriseras eftersom molekylerna som utgör dem är konfigurerade på samma sätt, vilket upprepas som ett mönster genom hela kristallen. Varje mönster kallas en enhetscell.
Kristallina fasta ämnen kännetecknas också av att de har en definierad smältpunkt; Detta innebär att, med tanke på enhetligheten i arrangemanget av dess molekyler, finns det samma avstånd mellan varje enhetscell, vilket gör att hela strukturen kan transformeras konstant under samma temperatur..
Exempel på kristallina fasta ämnen kan vara salt och socker..
Amorfa fasta ämnen
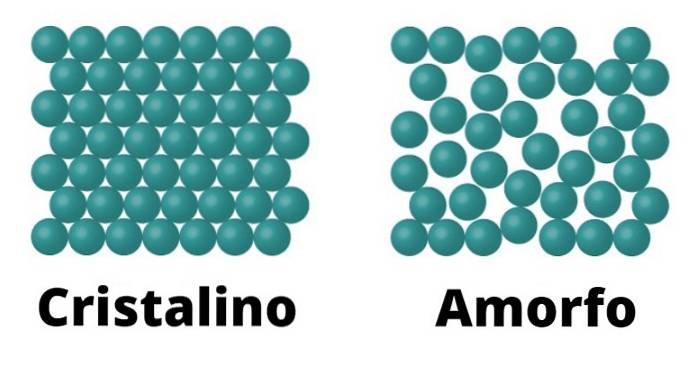
Amorfa fasta ämnen kännetecknas av att konformationen av deras molekyler inte svarar på ett mönster utan snarare varierar över hela ytan.
Eftersom det inte finns något sådant mönster definieras inte smältpunkten för amorfa fasta ämnen, till skillnad från kristallina, vilket innebär att det smälter gradvis och under olika temperaturer..
Exempel på amorfa fasta ämnen kan vara glas och de flesta plaster.
Jonik
Joniska fasta ämnen kännetecknas av att ha katjoner och anjoner, som interagerar med varandra genom elektrostatisk attraktion (jonbindning). När jonerna är små är de resulterande strukturerna vanligtvis alltid kristallina (med hänsyn till deras defekter). Bland några joniska fasta ämnen har vi:
-NaCl (Na+Cl-), natriumklorid
-MgO (Mgtvå+ELLERtvå-), magnesiumoxid
-Tjuv3 (ACtvå+CO3två-), kalciumkarbonat
-KURS4 (Cutvå+SW4två-), kopparsulfat
-KF (K+F-kaliumfluorid
-NH4Cl (NH4+Cl-), ammoniumklorid
-ZnS (Zntvå+Stvå-zinksulfid
-Fe (C6H5KUTTRA)3, järnbensoat
Metallisk
Som namnet antyder är de fasta ämnen som har metallatomer som interagerar genom metallbindningen:
-Silver
-Guld
-Leda
-Mässing
-Brons
-vitt guld
-Tenn
-Stål
-Duraluminium
Observera att legeringar också räknas som metalliska fasta ämnen.
Atom
Metallfasta ämnen är också atomära, eftersom det i teorin inte finns några kovalenta bindningar mellan metallatomer (M-M). Emellertid räknas ädelgaser i huvudsak som atomarter, eftersom endast Londons dispersiva krafter dominerar bland dem..
Därför, även om de inte är fasta ämnen med hög applicering (och svåra att erhålla), är kristalliserade ädelgaser exempel på atomfasta ämnen; dvs: helium, neon, argon, krypton, etc., fasta ämnen.
Molekylär och polymer
Molekyler kan interagera genom Van der Walls-krafter, där deras molekylmassor, dipolmoment, vätebindningar, strukturer och geometrier spelar en viktig roll. Ju starkare sådana interaktioner är, desto mer sannolikt är de att vara i form av ett fast ämne.
Å andra sidan gäller samma resonemang för polymerer, som på grund av deras höga genomsnittliga molekylmassor nästan alltid är fasta ämnen, och flera av dem är amorfa; eftersom dess polymera enheter har svårt att ordna sig för att skapa kristaller.
Således har vi bland några molekylära och polymera fasta ämnen följande:
-Torris

-Socker
-Jod
-Bensoesyra
-Acetamid
-Rhombiskt svavel
-Palmitinsyra
-Fullerenes
-Match
-Koffein
-Naftalen
-Trä och papper
-Silke
-Teflon
-Polyeten
-Kevlar
-Bakelit
-Polyvinylklorid
-Polystyren
-Polypropylen
-Protein
-Chokladkaka
Kovalenta nätverk
Slutligen har vi de kovalenta nätverken mellan de hårdaste och mest smältande fasta ämnena. Några exempel är:
-Grafit
-Diamant
-Kvarts
-Kiselkarbid
-Bornitrid
-Aluminiumfosfid
-Galliumarsenid
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Wikipedia. (2019). Halvledarkemi. Återställd från: en.wikipedia.org
- Elsevier B.V. (2019). Halvledarkemi. ScienceDirect. Återställd från: sciencedirect.com
- Dr Michael Lufaso. (s.f.). Föreläsningsanteckningar för halvledarkemi. Återställd från: unf.edu
- askIITians. (2019). Allmänna egenskaper hos solid state. Återställd från: askiitians.com
- David Wood. (2019). Hur atomer och molekyler bildar fasta ämnen: mönster och kristaller. Studie. Återställd från: study.com



Ingen har kommenterat den här artikeln än.