
Fibronektinstruktur och funktioner

De fibronektin Det är en klass av glykoprotein som tillhör den extracellulära matrisen. Denna typ av protein är i allmänhet ansvarig för att fästa eller binda cellmembranet till kollagenfibrerna som finns på utsidan.
Namnet ”fibronektin” kommer från ett ord som består av två latinska ord, det första är “fiber" vilket betyder fiber eller glödtråd och den andra "Necter" vilket innebär att ansluta, länka, klistra in eller binda.
Fibronektin visualiserades först 1948 som en förorening av fibrinogen framställd genom Cohns kalla etanolfraktioneringsprocess. Detta identifierades som ett unikt plasmaglykoprotein som hade egenskaperna hos ett kallolösligt globulin..
Detta protein har hög molekylvikt och har associerats med en mängd olika funktioner i vävnader. Dessa inkluderar vidhäftning mellan cell och cell, organisation av cytoskelettet, onkogen transformation, bland andra..
Fibronektin distribueras till många ställen i kroppen genom sin lösliga form i blodplasma, cerebrospinalvätska, synovialvätska, fostervätska, sädesvätska, saliv och inflammatoriska utsöndringar..
Forskare har rapporterat att plasmakoncentrationen av fibronektin ökar när gravida kvinnor lider av preeklampsi. Således har denna ökning av koncentrationen av fibronektin införlivats av specialister för att diagnostisera detta tillstånd..
Artikelindex
- 1 Struktur
- 1.1 "Multi-adhesion" -domäner och -egenskaper
- 2 funktioner
- 3 Referenser
Strukturera
Fibronektiner är stora glykoproteiner, som har en molekylvikt på cirka 440 kDa. De består av cirka 2300 aminosyror, som representerar 95% av proteinet, eftersom de andra 5% är kolhydrater.
De olika analyserna som har utförts på den genomiska och transkriptomiska sekvensen (budbärar-RNA) av proteinet har indikerat att det består av tre block av upprepade homologa sekvenser, med längder på 45, 60 och 90 aminosyror vardera..
De tre typerna av sekvenser utgör mer än 90% av den totala strukturen av fibronektiner. Homologa typ I- och II-sekvenser är slingor kopplade till varandra genom disulfidbroar. Dessa öglor innehåller 45 respektive 60 aminosyrarester..
Homologa typ III-sekvenser motsvarar 90 aminosyror ordnade linjärt och utan inre disulfidbryggor. Några av de inre aminosyrorna av homologa typ III-sekvenser har emellertid fria sulfvätegrupper (R-S-H).
De tre homologa sekvenserna viks och organiseras i en mer eller mindre linjär matris för att bilda två "dimera armar" av nästan identiska proteinunderenheter. Skillnader mellan de två underenheterna härrör från mognadshändelser efter transkription.
Fibronektiner kan i allmänhet ses på två sätt. En öppen form som observeras när de deponeras på ytan av membranet och som de är redo att binda med någon annan komponent i cellens yttre. Denna form ses endast med elektronmikroskopi..
Den andra formen kan ses i fysiologiska lösningar. Ändarna på varje arm eller förlängning är vikta mot mitten av proteinet och förenas genom karboxyländarna på kollagenbindningsställena. I denna form har proteinet ett globulärt utseende.
"Multi-adhesion" -domäner och -egenskaper
Multi-vidhäftningsegenskaperna hos fibronektin härrör från närvaron av olika domäner som har höga affinitetsvärden för olika substrat och proteiner..
De "dimeriska armarna" kan delas in i 7 olika funktionella domäner. Dessa klassificeras enligt substratet eller domänen som var och en binder till. Exempel: Domän 1 och Domän 8 är fibrinproteinbindande domäner.
Domän 2 har kollagenbindningsegenskaper, domän 6 är en celladhesionsregion, det vill säga den låter den förankra sig på nästan vilket membran eller varje yttre yta som helst på cellerna. Funktionerna för domänerna 3 och 5 är fortfarande okända idag.
I domän 9 är karboxyländen eller den C-terminala änden av proteinet lokaliserad. Celladhesionsregionerna i domän 6 har tripeptiden bestående av aminosyrasekvensen Arginin-glycin-asparagin (Arg-Gly-Asp).
Denna tripeptid delas av flera proteiner såsom kollagen och integriner. Det är den minsta struktur som krävs för igenkänning av plasmamembranet av fibronektiner och integriner..
Fibronektin, när det är i sin globulära form, representerar en löslig och fri form i blodet. Men på cellytor och i den extracellulära matrisen finns den i en ”öppen”, stel och olöslig form..
Funktioner
Några av de processer där fibronektins deltagande utmärker sig är cell-till-cell-bindning, cellbindning, anslutning eller vidhäftning till plasma eller basala membran, stabilisering av blodproppar och sårläkning..
Celler vidhäftar till ett specifikt ställe på fibronektin genom ett receptorprotein som kallas "integrin". Detta protein passerar plasmamembranet till det inre av cellen.
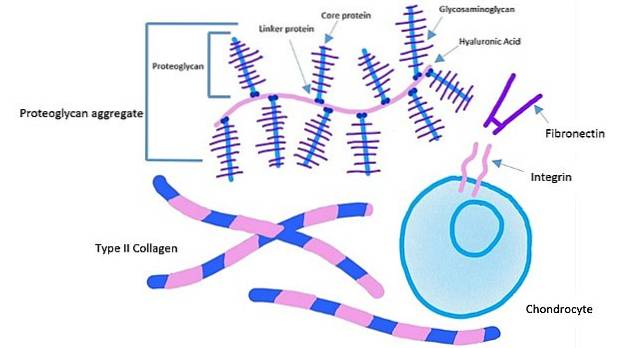
Den extracellulära domänen av integriner binder till fibronektin, medan den intracellulära domänen av integriner är bunden till aktinfilament. Denna typ av förankring gör det möjligt att överföra spänningen som alstras i den extracellulära matrisen till cellernas cytoskelett..
Fibronektiner deltar i sårläkningsprocessen. Dessa, i sin lösliga form, avsätts på kollagenfibrerna intill såret, vilket hjälper migrationen av fagocyter, fibroblaster och cellproliferation i det öppna såret..
Den faktiska läkningsprocessen börjar när fibroblaster "snurrar" fibronektinnätverket. Detta nätverk fungerar som ett slags byggnadsställning eller stöd för avsättning av de nya kollagenfibrerna, heparansulfat, proteoglykan, kondrotinsultafo och de andra komponenterna i den extracellulära matrisen som krävs för att reparera vävnaden..
Fibronektin är också involverat i rörelsen av epidermala celler, eftersom det genom den granulära vävnaden hjälper till att omorganisera källmembranet som ligger under epidermis i vävnaderna, vilket hjälper keratinisering att inträffa..
Alla fibronektiner har väsentliga funktioner för alla celler; delta i processer så olika som cellmigrering och differentiering, homeostas, sårläkning, fagocytos, bland andra.
Referenser
- Conde-Agudelo, A., Romero, R., & Roberts, J. M. (2015). Tester för att förutsäga preeklampsi. I Chesleys hypertensiva störningar under graviditeten (s. 221-251). Academic Press.
- Farfán, J. Á. L., Tovar, H. B. S., de Anda, M. D. R. G., & Guevara, C. G. (2011). Fosterfibronektin och cervikal längd som tidiga prediktorer för för tidig leverans. Gynekologi och obstetrik i Mexiko, 79 (06), 337-343.
- Feist, E., & Hiepe, F. (2014). Fibronektin autoantikroppar. I autoantikroppar (s. 327-331). Elsevier.
- Letourneau, P. (2009). Axonal sökväg: Extracellulär matrisroll. Encyclopedia of neuroscience, 1, 1139-1145.
- Pankov, R., & Yamada, K. M. (2002). Fibronektin en överblick. Journal of cell science, 115 (20), 3861-3863.
- Proctor, R. A. (1987). Fibronektin: en kort översikt över dess struktur, funktion och fysiologi. Recensioner av infektionssjukdomar, 9 (Supplement_4), S317-S321.


Ingen har kommenterat den här artikeln än.