
Vätehistoria, struktur, egenskaper och användningsområden
De väte Det är ett kemiskt grundämne som representeras av symbolen H. Dess atom är den minsta av alla och det är med vilket det periodiska systemet börjar, oavsett var det är placerat. Den består av en färglös gas som består av diatomiska H-molekylertvå, och inte av isolerade H-atomer; som det händer med ädelgaserna Han, Ne, Ar, bland andra.
Av alla element är det kanske det mest emblematiska och enastående, inte bara för dess egenskaper i markbundna eller drastiska förhållanden, utan för dess enorma överflöd och mångfald av dess föreningar. Väte är en gas, även om den är inert i frånvaro av eld, brandfarlig och farlig. medan vatten, HtvåEller är det universella lösningsmedlet och livslängden.

I och för sig visar väte inte någon visuell särdrag värdig att beundra, utan bara en gas som lagras i cylindrar eller röda flaskor. Det är dock dess egenskaper och förmåga att binda med alla element, vilket gör väte speciellt. Och allt detta, trots att det bara har en valenselektron.
Om vätet inte lagrades i sina respektive cylindrar skulle det fly ut i rymden medan mycket av det reagerar vid uppstigningen. Och även om den har en mycket låg koncentration i luften vi andas, utanför jorden och i resten av universum, är det det vanligaste elementet, som finns i stjärnorna och betraktas som dess konstruktionsenhet..
På jorden, å andra sidan, representerar den cirka 10% av dess totala massa. För att visualisera vad detta betyder måste man överväga att planetens yta praktiskt taget är täckt av hav och att väte finns i mineraler, i råolja och i vilken organisk förening som helst, förutom att vara en del av alla levande varelser.
Liksom kol har alla biomolekyler (kolhydrater, proteiner, enzymer, DNA, etc.) väteatomer. Därför finns det många källor för att extrahera eller producera det men få representerar verkligt lönsamma produktionsmetoder.
Artikelindex
- 1 Historia
- 1.1 Identifiering och namn
- 1.2 Elektrolys och bränsle
- 1.3 Isolering
- 1.4 Två kanaler
- 2 Struktur och elektronisk konfiguration
- 2.1 oxidationsnummer
- 2.2 Faser
- 3 fastigheter
- 3.1 Fysiskt utseende
- 3.2 Kokpunkt
- 3.3 Smältpunkt
- 3.4 Flampunkt och stabilitet
- 3.5 Densitet
- 3.6 Löslighet
- 3.7 Ångtryck
- 3.8 Självantändningstemperatur
- 3.9 Elektronegativitet
- 3.10 Förbränningsvärme
- 3.11 Förångningsvärme
- 3.12 Fusionsvärme
- 3.13 Isotoper
- 3.14 Isomerer av snurr
- 4 Nomenklatur
- 5 Väteatomen
- 6 Var man kan hitta och producera
- 6.1 Naturligt
- 6.2 Industriell
- 6.3 I laboratoriet
- 7 Reaktioner
- 7.1 Redox
- 7.2 Absorption
- 7.3 Tillägg
- 7.4 Hydridbildning
- 8 användningsområden
- 8.1 Råmaterial
- 8.2 Reduktionsmedel
- 8.3 Oljeindustrin
- 8.4 Bränsle
- 9 Referenser
Berättelse
Identifiering och namn
Även om Robert Boyle 1671 först bevittnade en gas som bildades när järnfilm reagerade med syror, var det den brittiska forskaren Henry Cavendish 1766 som identifierade den som ett nytt ämne; den "brandfarliga luften".
Cavendish fann att när denna förment brandfarliga luft brann, genererades vatten. Baserat på hans arbete och resultat gav den franska kemisten Antoine Lavoisier denna gas namnet väte 1783. Etymologiskt kommer dess betydelse från de grekiska orden "hydro" och "gener": bildande av vatten.
Elektrolys och bränsle
Strax efter, 1800, upptäckte amerikanska forskare William Nicholson och Sir Anthony Carlisle att vatten kan brytas ned till väte och syre; de hade hittat elektrolys av vatten. Senare 1838 introducerade den schweiziska kemisten Christian Friedrich Schoenbein idén att dra nytta av förbränningen av väte för att generera el.
Vätgas popularitet var så stor att även författaren Jules Verne hänvisade till det som framtidens bränsle i sin bok Den mystiska ön (1874).
Isolering
År 1899 var den skotska kemisten James Dewar den första som isolerade väte som en flytande gas och var själv den som kunde svalna det tillräckligt för att få det i sin fasta fas..
Två kanaler
Från denna punkt presenterar vätehistorien två kanaler. Å ena sidan dess utveckling inom bränslen och batterier; och å andra sidan förståelsen av dess atoms struktur och hur den representerade elementet som öppnade dörrarna för kvantfysik.
Struktur och elektronisk konfiguration

Väteatomer är mycket små och har bara en elektron för att bilda kovalenta bindningar. När två av dessa atomer förenas ger de upphov till en diatomisk molekyl, Htvå; detta är molekylär vätgas (toppbild). Varje vit sfär motsvarar en enskild H-atom och den globala sfären med de molekylära orbitalerna.
Så, väte består faktiskt av H-molekylertvå väldigt små som interagerar med hjälp av Londons spridningskrafter, eftersom de saknar ett dipolmoment eftersom de är homonukleära. Därför är de mycket "rastlösa" och sprider sig snabbt i rymden eftersom det inte finns intermolekylära krafter som är tillräckligt starka för att sakta ner dem..
Elektronkonfigurationen för väte är helt enkelt 1s1. Denna orbital, 1s, är produkten av att lösa den berömda Schrödinger-ekvationen för väteatomen. I Htvå två 1-orbitaler överlappar varandra för att bilda två molekylära orbitaler: en bindning och en anti-bindning, enligt molekylär orbitalteori (TOM).
Dessa orbitaler tillåter eller förklarar förekomsten av H-jonertvå+ eller Htvå-; emellertid definieras kemin för väte under normala förhållanden av Htvå eller H-joner+ eller H-.
Oxidationsnummer
Från elektronkonfigurationen för väte, 1s1, dess möjliga oxidationsnummer är mycket lätta att förutsäga; med tanke på, naturligtvis, att 2-orbitalen med högre energi inte är tillgänglig för kemiska bindningar. Således, i basalt tillstånd, har väte ett oxidationsnummer på 0, H0.
Om den förlorar sin enda elektron förblir 1s-banan tom och vätejonen eller katjonen, H, bildas.+, mycket mobil i nästan vilket flytande medium som helst; särskilt vattnet. I detta fall är dess oxidationsnummer +1.
Och när det motsatta händer, det vill säga att få en elektron, kommer banan nu att ha två elektroner och blir 1stvå. Då blir oxidationsantalet -1 och motsvarar hydridanjonen, H-. Det är värt att notera att H- det är isoelektroniskt mot ädelgasen helium, He; det vill säga båda arterna har samma antal elektroner.
Sammanfattningsvis är oxidationsnumren för väte: +1, 0 och -1 och H-molekylentvå räknas ha två väteatomer H0.
Faser
Den föredragna fasen av väte, åtminstone under markförhållanden, är den gasformiga på grund av de tidigare exponerade skälen. Men när temperaturen sjunker i storleksordningen -200 ° C, eller om trycket ökar hundratusentals gånger det atmosfäriska, kan väte kondensera eller kristallisera till en flytande eller fast fas..
Under dessa förhållanden kan molekylerna Htvå de kan anpassas på olika sätt för att definiera strukturella mönster. Londons spridningskrafter blir nu mycket riktade och därför uppträder geometrier eller symmetrier antagna av par H.två.
Till exempel två par Htvå, det är lika med att skriva (Htvå)två definiera en symmetrisk eller asymmetrisk kvadrat. Under tiden tre par Htvå, eller (Htvå)3 definiera en hexagon, ungefär som de av kol i grafitkristaller. I själva verket är denna sexkantiga fas den huvudsakliga eller mest stabila fasen för fast väte..
Men tänk om det fasta ämnet inte bestod av molekyler utan av H-atomer? Då skulle vi hantera metalliskt väte. Dessa H-atomer, som påminner om de vita sfärerna, kan definiera både en flytande fas och ett metalliskt fast ämne..
Egenskaper
Fysiskt utseende
Väte är en färglös, luktfri och smaklös gas. Därför, om det finns en läcka, innebär det en explosionsrisk..
Kokpunkt
-253 ºC.
Smältpunkt
-259 ºC.
Flampunkt och stabilitet
Det exploderar vid nästan vilken temperatur som helst om det finns en gnista eller värmekälla nära gasen, även solljus kan antända väte. Men så länge det är väl lagrat är det en dåligt reaktiv gas..
Densitet
0,082 g / L. Det är 14 gånger lättare än luft.
Löslighet
1,62 mg / L vid 21 ºC i vatten. Det är i allmänhet olösligt i de flesta vätskor.
Ångtryck
1,24 106 mmHg vid 25 ° C Detta värde ger en uppfattning om hur stängda vätecylindrarna måste vara för att förhindra att gas släpps ut.
Självantändningstemperatur
560vºC.
Elektronnegativitet
2.20 på Pauling-skalan.
Förbränningsvärme
-285,8 kJ / mol.
Förångningsvärme
0,90 kJ / mol.
Fusionsvärme
0,117 kJ / mol.
Isotoper
Den "normala" väteatomen är protiumet, 1H, som utgör cirka 99,985% väte. De andra två isotoperna för detta element är deuterium, tvåH och tritium, 3H. Dessa skiljer sig åt i antalet neutroner; deuterium har en neutron, medan tritium har två.
Snurrisomerer
Det finns två typer av molekylärt väte, Htvå: orto och para. I den första orienteras de två snurrarna (av protonen) av H-atomerna i samma riktning (de är parallella); medan i det andra är de två snurrningarna i motsatta riktningar (de är antiparallella).
Väte-para är den mer stabila av de två isomererna; men med ökande temperatur blir orto: para-förhållandet 3: 1, vilket betyder att väte-orto-isomeren dominerar över den andra. Vid mycket låga temperaturer (fjärr nära absolut noll, 20K) kan rena väteprover erhållas - för.
Nomenklatur
Nomenklaturen för att hänvisa till väte är en av de enklaste; även om det inte är samma sätt för dess oorganiska eller organiska föreningar. Htvå Det kan kallas med följande namn förutom 'väte':
-Molekylärt väte
-Dihydrogen
-Diatomisk vätemolekyl.
För H-jonen+ deras namn är proton eller vätejon; och om det är i ett vattenhaltigt medium, H3ELLER+, hydronium katjon. Medan H-ionen- är hydridanjonen.
Väteatomen
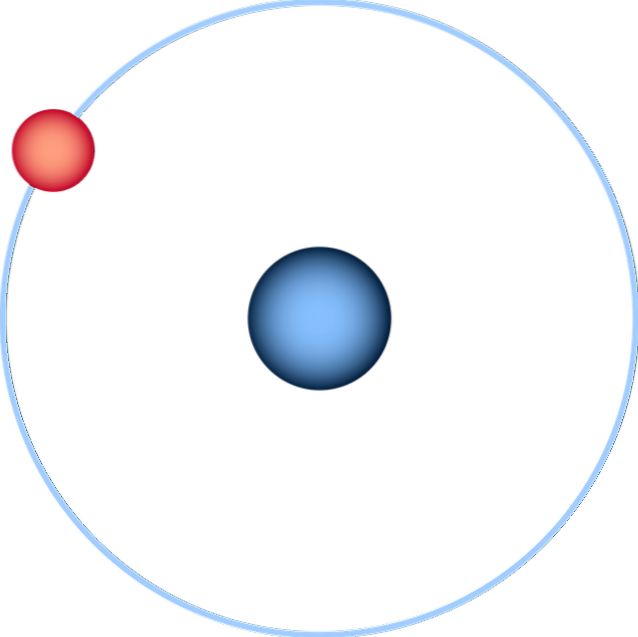
Väteatomen är den enklaste av alla och representeras normalt som i bilden ovan: en kärna med en enda proton (för 1H), omgiven av en elektron som drar en bana. Alla atomorbitaler för de andra elementen i det periodiska systemet har konstruerats och uppskattats på denna atom..
En mer trogen framställning av den nuvarande förståelsen av atomer skulle vara den för en sfär vars periferi definieras av elektronens och det probabilistiska molnet för elektronen (dess 1s-omlopp).
Var det är placerat och produktion

Väte är, även om det kanske i mindre grad jämfört med kol, det kemiska elementet som utan tvekan kan sägas vara överallt; i luften, som utgör en del av vattnet som fyller haven, haven och våra kroppar, i råolja och mineraler, såväl som i de organiska föreningarna som är sammansatta för att skapa sitt liv.
Det räcker att skumma alla bibliotek av föreningar för att hitta väteatomer i dem..
Frågan är inte så mycket hur mycket utan hur den är närvarande. Till exempel kan molekylen Htvå den är så flyktig och reaktiv under förekomsten av solstrålar att den är mycket knapp i atmosfären; därför reagerar det på att gå med i andra element och därmed vinna stabilitet.
Medan högre uppe i kosmos finns väte huvudsakligen som neutrala atomer, H.
I själva verket anses väte i sin metalliska och kondenserade fas vara byggstenen för stjärnor. Eftersom det finns omätbara mängder av dem och på grund av dess robusthet och kolossala dimensioner gör de detta element till det mest förekommande i hela universum. Det uppskattas att 75% av känt material motsvarar väteatomer.
naturlig
Att samla lösa väteatomer i rymden låter opraktiskt och extrahera dem från solens periferier, eller nebulosor, ouppnåeligt. På jorden, där dess förhållanden tvingar detta element att existera som Htvå, kan produceras genom naturliga eller geologiska processer.
Till exempel har väte sin egen naturliga cykel där vissa bakterier, mikrober och alger kan generera det genom fotokemiska reaktioner. Skalningen av naturliga processer och parallellt med dessa inkluderar användning av bioreaktorer, där bakterier matar på kolväten för att frigöra vätet i dem.
Levande saker är också väteproducenter, men i mindre grad. Om detta inte var fallet skulle det inte vara möjligt att förklara hur det utgör en av gasformiga komponenter i flatulens; som har visat sig vara alltför brandfarliga.
Slutligen bör det nämnas att under anaeroba förhållanden (utan syre), till exempel i underjordiska lager, kan mineraler reagera långsamt med vatten för att producera väte. Fayelitas reaktion bevisar det:
3FetvåJa4 + 2 timmartvåO → 2 Fe3ELLER4 + 3 SiOtvå + 3 Htvå
Industriell
Även om bioväte är ett alternativ för att generera denna gas i industriell skala, består de mest använda metoderna praktiskt taget av att "ta bort" väte från föreningarna som innehåller den, så att dess atomer förenas och bildar Htvå.
De minst miljövänliga metoderna för att producera den består av att reagera koks (eller kol) med överhettad ånga:
C (s) + HtvåO (g) → CO (g) + Htvå(g)
På samma sätt har naturgas använts för detta ändamål:
CH4(g) + HtvåO (g) → CO (g) + 3Htvå(g)
Och eftersom mängderna koks eller naturgas är stora är det lönsamt att producera väte genom någon av dessa två reaktioner..
En annan metod för att erhålla väte är att applicera en elektrisk urladdning på vatten för att bryta ner det i dess elementdelar (elektrolys):
2 timmartvåO (l) → 2 Htvå(g) + Otvå(g)
På laboratoriet
Molekylärt väte kan framställas i små mängder i vilket laboratorium som helst. För att göra detta måste en aktiv metall reageras med en stark syra, antingen i en bägare eller i ett provrör. Den observerbara bubblan är ett tydligt tecken på vätebildning, representerad av följande allmänna ekvation:
M (s) + nH+(ac) → Mn+(ac) + Htvå(g)
Där n är metallens valens. Till exempel reagerar magnesium med H+ att producera Htvå:
Mg (s) + 2H+(ac) → Mgtvå+(ac) + Htvå(g)
Reaktioner
Redox
Oxidationsnumren i sig ger en första glimt av hur väte deltar i kemiska reaktioner. Htvå när den reagerar kan den förbli oförändrad eller delas upp i H-jonerna+ eller H- beroende på vilken art det är kopplat till; om de är mer eller mindre elektronegativa än honom.
Htvå den är inte särskilt reaktiv på grund av styrkan i dess kovalenta bindning, H-H; Detta är dock inte ett absolut hinder för att det ska reagera och bilda föreningar med nästan alla element i det periodiska systemet..
Dess mest kända reaktion är med syrgas för att producera vattenångor:
Htvå(g) + Otvå(g) → 2HtvåO (g)
Och sådan är dess affinitet för syre att bilda den stabila vattenmolekylen att den till och med kan reagera med den som en O-anjon.två- i vissa metalloxider:
Htvå(g) + CuO (s) → Cu (s) + HtvåO (l)
Även silveroxid reagerar eller "reduceras" genom samma reaktion:
Htvå(g) + AgO (s) → Ag (s) + HtvåO (l)
Dessa vätereaktioner motsvarar redoxtypen. Det vill säga reduktion-oxidation. Väte oxiderar både i närvaro av syre och av metalloxider av metaller som är mindre reaktiva än det; till exempel koppar, silver, volfram, kvicksilver och guld.
Absorption
Vissa metaller kan absorbera vätgas för att bilda metallhydrider, som anses vara legeringar. Exempelvis absorberar övergångsmetaller såsom palladium betydande mängder Htvå, liknar metalliska svampar.
Detsamma händer med mer komplexa metalllegeringar. På detta sätt kan väte lagras på annat sätt än dess cylindrar..
Tillägg
Organiska molekyler kan också "absorbera" väte genom olika molekylära mekanismer och / eller interaktioner..
För metaller, molekyler Htvå de är omgivna av metallatomerna i deras kristaller; medan i organiska molekyler bryts H-H-bindningen för att bilda andra kovalenta bindningar. I en mer formaliserad mening: väte absorberas inte utan läggs till strukturen.
Det klassiska exemplet är tillägget av Htvå till dubbel- eller trippelbindningen för alkenerna respektive alkynerna:
C = C + Htvå → H-C-C-H
C2C + Htvå → HC = CH
Dessa reaktioner kallas också hydrogenering..
Hydridbildning
Väte reagerar direkt med grundämnen och bildar en familj av kemiska föreningar som kallas hydrider. Det finns huvudsakligen två typer: saltlösning och molekylär.
Likaså finns det metallhydrider, som består av de metalllegeringar som redan nämnts när dessa metaller absorberar vätgas; och de polymera, med nätverk eller kedjor av länkar E-H, där E betecknar det kemiska elementet.
Salin
I saltlösning hydrider deltar väte i jonbindning som hydridanjonen, H-. För att detta ska bildas måste elementet nödvändigtvis vara mindre elektronegativt; annars skulle det inte ge upp sina elektroner för väte.
Därför bildas saltlösning endast när väte reagerar med mycket elektropositiva metaller, såsom alkali och alkalisk jord..
Till exempel reagerar väte med metalliskt natrium för att producera natriumhydrid:
2Na (s) + Htvå(g) → 2NaH (s)
Eller med barium för att producera bariumhydrid:
Ba (s) + Htvå(g) → BaHtvå(s)
Molekyl
Molekylära hydrider är ännu bättre kända än joniska. De kallas också vätehalogenider, HX, när väte reagerar med en halogen:
Cltvå(g) + Htvå(g) → 2HCl (g)
Här deltar väte i den kovalenta bindningen som H+; eftersom skillnaderna mellan elektronegativiteterna mellan båda atomerna inte är så stora.
Samma vatten kan betraktas som en syrehydrid (eller väteoxid), vars bildningsreaktion redan har diskuterats. Mycket lika är reaktionen med svavel för att ge vätesulfid, en illaluktande gas:
S (s) + Htvå(g) → HtvåS (g)
Men av alla molekylära hydrider är den mest kända (och kanske den svåraste att syntetisera) ammoniak:
Ntvå(g) + 3Htvå(g) → 2NH3(g)
Applikationer
I föregående avsnitt behandlades en av de viktigaste användningarna av väte redan: som ett råmaterial för utveckling av syntes, oorganiskt eller organiskt. Kontroll av denna gas har vanligtvis inget annat syfte än att få den att reagera för att skapa andra föreningar än de från vilka den extraherades..
Råmaterial
- Det är ett av reagenserna för syntesen av ammoniak, som i sin tur har oändliga industriella tillämpningar, som börjar med produktion av gödselmedel, till och med som ett material för kvävgasdroger..
- Det är avsett att reagera med kolmonoxid och därmed massivt producera metanol, ett reagens som är mycket viktigt i biobränslen..
Reduktionsmedel
- Det är ett reduktionsmedel för vissa metalloxider, så det används vid metallurgisk reduktion (redan förklarat för koppar och andra metaller).
- Minska fetter eller oljor för att producera margarin.
Oljeindustri
I oljeindustrin används väte för att "hydrobehandla" råolja i raffineringsprocesser..
Det försöker till exempel att fragmentera stora och tunga molekyler i små molekyler med större efterfrågan på marknaden (hydrokrackning); frigöra metaller som fångats i petroporfyrinburarna (hydrodemetallisering); avlägsna svavelatomer som HtvåS (hydroavsvavling); eller minska dubbelbindningar för att skapa paraffinrika blandningar.
Bränsle
Väte i sig är ett utmärkt bränsle för raketer eller rymdfarkoster, eftersom små mängder av det, när de reagerar med syre, släpper ut stora mängder värme eller energi.
I mindre skala används denna reaktion för design av väteceller eller batterier. Dessa celler har emellertid svårigheterna med att inte kunna lagra denna gas ordentligt; och utmaningen att bli helt oberoende av att bränna fossila bränslen.
På den positiva sidan släpper väte som används som bränsle endast vatten; istället för gaser som representerar föroreningsmedel för atmosfären och ekosystemen.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Hanyu Liu, Li Zhu, Wenwen Cui och Yanming Ma. (S.f.). Rumstemperaturstrukturer av fast väte vid höga tryck. State Key Lab of Superhard Materials, Jilin University, Changchun 130012, Kina.
- Pierre-Marie Robitaille. (2011). Flytande metallväte: en byggsten för den flytande solen. Institutionen för radiologi, Ohio State University, 395 W. 12th Ave, Columbus, Ohio 43210, USA.
- Bodner-gruppen. (s.f.). Vätekemi. Återställd från: chemed.chem.purdue.edu
- Wikipedia. (2019). Väte. Återställd från: en.wikipedia.org
- Väte Europa. (2017). Väteapplikationer. Återställd från: hydrogeneurope.eu
- Foist Laura. (2019). Väte: Egenskaper och förekomst. Studie. Återställd från: study.com
- Jonas James. (4 januari 2009). Vätgas historia. Återställd från: altenergymag.com


Ingen har kommenterat den här artikeln än.