
Magnesiumfluoridstruktur, egenskaper, syntes, användningsområden
De magnesiumfluorid det är ett färglöst oorganiskt salt vars kemiska formel är MgF2. Det finns i naturen som mineralet sellait. Den har en mycket hög smältpunkt och är mycket dålig löslig i vatten. Den är relativt inert, eftersom dess reaktion med svavelsyra till exempel är långsam och ofullständig och motstår hydrolys med fluorvätesyra (HF) upp till 750 ° C..
Det är en förening som lite påverkas av strålning med hög energi. Dessutom har den ett lågt brytningsindex, hög korrosionsbeständighet, god termisk stabilitet, betydande hårdhet och utmärkt synlig, UV (ultraviolett) och IR (infraröd) ljusöverföringsegenskaper..
Dessa egenskaper gör att den har utmärkta prestanda inom det optiska området och gör det dessutom till ett användbart material som katalysatorbärare, beläggningselement, antireflekterande linser och fönster för infraröd överföring, bland andra applikationer..
Artikelindex
- 1 Struktur
- 2 fastigheter
- 3 Syntes och förberedelse
- 4 användningsområden
- 4.1 Optik
- 4.2 Katalysering eller acceleration av reaktioner
- 4.3 Andra användningsområden
- 5 Referenser
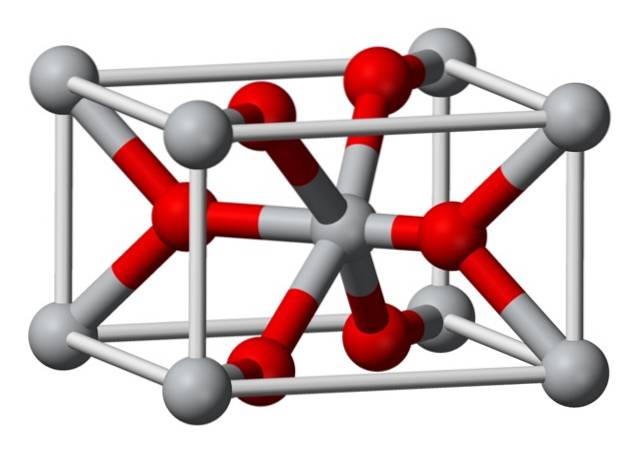
Strukturera
Den kristallina strukturen hos kemiskt framställd magnesiumfluorid är av samma typ som den för det naturliga mineralet sellait. Kristalliserar sig i den dipyramidala klassen i det tetragonala systemet.
Magnesiumjoner (Mg2 +) är belägna i ett centrerat tetragonal gitterutrymme, medan fluorjoner (F-) finns i samma plan som och associerade med deras Mg2 + -grannar, grupperade i par med varandra. Avståndet mellan Mg2 + och F-jonerna är 2,07 Å (ångström) (2,07 × 10-10m).
Dess kristallkoordination är 6: 3. Detta innebär att varje Mg2 + -jon omges av 6 F-joner och varje F-jon i sin tur omges av 3 Mg2 + 5-joner..
Strukturen är mycket lik den hos mineralet rutil, som är den naturliga formen av titandioxid (TiO2), med vilken den har flera kristallografiska egenskaper gemensamt..
Under framställningen fälls inte magnesiumfluorid ut som ett amorft fast ämne, eftersom Mg2 + och F-jonerna inte tenderar att bilda polymera komplex i lösning..
Egenskaper
Intressant är att magnesiumfluorid är ett dubbelbrytande material. Detta är en optisk egenskap som gör att en infallande ljusstråle kan delas i två separata strålar som sprider sig vid olika hastigheter och våglängder..
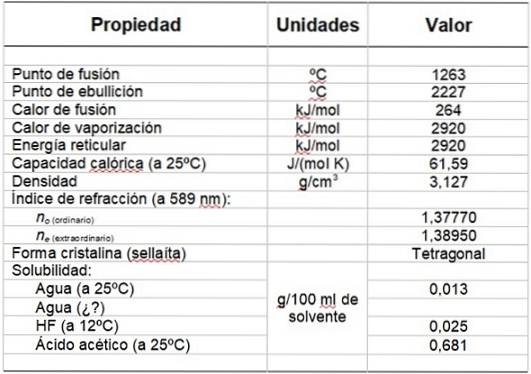
Tabell 1 visar några av dess egenskaper.
Tabell 1. Fysikaliska och kemiska egenskaper hos magnesiumfluorid.
Syntes och förberedelse
Den kan beredas på olika sätt, inklusive följande:
1-Genom reaktionen mellan magnesiumoxid (MgO) eller magnesiumkarbonat (MgCO3) med fluorvätesyra (HF) 2:
MgO + 2 HF MgF2 + H2O
MgCO3 + 2 HF MgF2 + CO2 + H2O
2-genom-reaktion mellan magnesiumkarbonat och ammoniumbifluorid (NH4HF2), båda i fast tillstånd, vid en temperatur mellan 150 och 400 ° C2:
150-400ºC
MgCO3 + NH4HF2 MgF2 + NH3 + CO2 + H2O
3-Uppvärmning av en vattenlösning av magnesiumkarbonat och ammoniumfluorid (NH4F) i närvaro av ammoniumhydroxid (NH4OH) vid 60 ° C 2:
60 ° C, NH4OH
MgCO3 + 3 NH4F NH4MgF3 + (NH4) 2CO3
Den resulterande fällningen av magnesiumammoniumfluorid (NH4MgF3) upphettas sedan vid 620 ° C under 4 timmar för erhållande av magnesiumfluorid:
620ºC
NH4MgF3 MgF2 + NH3 + HF
4-Som en biprodukt från erhållande av beryllium (Be) och uran (U). Fluoriden hos det önskade elementet upphettas med metalliskt magnesium i en degel belagd med MgF2 2:
BeF2 + Mg Be + MgF2
5-reagerande magnesiumklorid (MgCl2) med ammoniumfluorid (NH4F) i vattenlösning vid rumstemperatur 3:
25 ° C, H2O
MgCl2 + 2 NH4F MgF2 + 2NH4Cl
Eftersom metoderna för framställning av MgF2 är dyra, finns det försök att få det mer ekonomiskt, bland vilket metoden att producera den med början från havsvatten sticker ut..
Detta kännetecknas av att tillsätta en tillräcklig mängd fluorjoner (F-) till havsvatten, som har en riklig koncentration av magnesiumjoner (Mg2 +), vilket gynnar utfällningen av MgF2..
Optiska kristaller av magnesiumfluorid erhålls genom varmpressning av högkvalitativt MgF2-pulver, erhållet till exempel med NH4HF2-metoden.
Det finns många tekniker för framställning av magnesiumfluoridmaterial, såsom enkelkristalltillväxt, sintring (komprimering till formning eller formning) utan tryck, varmpressning och mikrovågssintring..
Applikationer
Optik
MgF2-kristaller är lämpliga för optiska applikationer eftersom de är transparenta från UV-regionen till det mellersta IR-området 2.10.
Som en inert film används den för att ändra ljustransmissionsegenskaperna hos optiska och elektroniska material. En av de viktigaste applikationerna är inom VUV-optik för rymdutforskningsteknik.
På grund av dess dubbelbrytningsegenskap är detta material användbart i polariseringsoptik, i fönster och prismor i Excimer Laser (en typ av ultraviolett laser som används vid ögonkirurgi)..
Det bör noteras att magnesiumfluoriden som används vid tillverkningen av tunnfilmsoptiska material måste vara fri från föroreningar eller föreningar som är en källa till oxid, såsom vatten (H2O), hydroxidjoner (OH-), karbonatjoner (CO3 = sulfatjoner (SO4 =) och liknande 12.
Katalys eller acceleration av reaktioner
MgF2 har framgångsrikt använts som ett katalysatorunderlag för reaktionen av eliminering av klor och tillsats av väte i CFC (klorfluorkolväten), kända kylmedel och aerosoldrivmedel, och ansvarar för skadorna på atmosfärens ozonskikt.
De resulterande föreningarna, HFC (fluorkolväten) och HCFC (hydroklorfluorkolväten) uppvisar inte denna skadliga effekt för atmosfären 5.
Det har också varit användbart som en katalysatorbärare för hydroavsvavling (avlägsnande av svavel) av organiska föreningar..
Andra användningsområden
Materialen som genereras genom interkalering av grafit, fluor och MgF2 uppvisar hög elektrisk ledningsförmåga, varför de har föreslagits för användning i katoder och som elektriskt ledande material..
Eutektiken som bildas av NaF och MgF2 har energilagringsegenskaper i form av latent värme, varför det har övervägs att användas i solenergisystem..
Inom området biokemi används magnesiumfluorid tillsammans med andra metallfluorider för att hämma fosforylöverföringsreaktioner i enzymer..
Nyligen har MgF2-nanopartiklar testats framgångsrikt som läkemedelsleveransvektorer i sjuka celler för behandling av cancer..
Referenser
- Buckley, H.E. och Vernon, W.S. (1925) XCIV. Kristallstrukturen av magnesiumfluorid. Philosophical Magazine Series 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology, Volym 11, femte upplagan, John Wiley & Sons. ISBN 0-471-52680-0 (v.11).
- Peng, Minhong; Cao, Weiping; och Song, Jinhong. (2015). Framställning av MgF2 genomskinlig keramik genom varmpressande sintring. Journal of Wuhan University of Technology-Mater: Sci. Ed. Vol. 30 nr 4.
- Непоклонов, И.С. (2011). Magnesiumfluorid. Källa: Eget arbete.
- Wojciechowska, Maria; Zielinski, Michal; och Pietrowski, Mariusz. (2003). MgF2 som en icke-konventionell katalysatorbärare. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Magnesiumfluorid (MgF2). Hämtad 12-07-2019 på: korth.de
- Sevonkaev, Igor och Matijevic, Egon. (2009). Bildning av magnesiumfluoridpartiklar av olika morfologier. Langmuir 2009, 25 (18), 10534-10539.
- Непоклонов, И.С. (2013). Magnesiumfluorid. Källa: Eget arbete.
- Tao Qin, Peng Zhang och Weiwei Qin. (2017). En ny metod för att syntetisera billiga magnesiumfluoridsfärer från havsvatten. Ceramics International 43 (2017) 14481-14483.
- Ullmann's Encyclopedia of Industrial Chemistry (1996) femte upplagan. Volym A11. VCH Verlagsgesellschaft mbH. New York. ISBN 0-89573-161-4.
- NASA (2013). Ingenjörer som inspekterar Hubble-rymdteleskopets primära spegel 8109563. Källa: mix.msfc.nasa.gov



Ingen har kommenterat den här artikeln än.