
Aluminiumfosfid (AIP) struktur, egenskaper, användningar, risker
De aluminiumfosfid Det är en oorganisk förening bildad av en aluminiumatom (Al) och en fosforatom (P). Dess kemiska formel är AlP. Det är en fast mörkgrå eller, om mycket ren, gul. Det är en extremt giftig förening för levande varelser.
Aluminiumfosfid reagerar med fukt och bildar fosfin eller fosfan PH3, vilket är en giftig gas. Av detta skäl får AlP inte komma i kontakt med vatten. Reagerar starkt med syror och alkaliska lösningar.

Det användes tidigare för att eliminera skadedjur som insekter och gnagare på platser där spannmålskorn och andra jordbruksprodukter lagrades. Men på grund av sin höga fara har det förbjudits i de flesta länder i världen..
För närvarande undersöks dess användbarhet inom elektronikområdet teoretiskt med hjälp av datorer som beräknar möjligheten att erhålla halvledar-AlP-nanorör, det vill säga extremt små rör som endast kan överföra elektricitet under vissa förhållanden..
Aluminiumfosfid är en mycket farlig förening, den måste hanteras med säkerhetsredskap som handskar, glasögon, andningsskydd och skyddskläder..
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Densitet
- 3.5 Löslighet
- 3.6 Kemiska egenskaper
- 3.7 Övriga egenskaper
- 4 Skaffa
- 5 användningsområden
- 5.1 Vid eliminering av skadedjur (avbruten användning)
- 5.2 I andra applikationer
- 6 Teoretisk undersökning av AlP-nanorör
- 6.1 AlP-nanorör med bor
- 6.2 AlP-nanorör med förändrad struktur
- 7 risker
- 8 Referenser
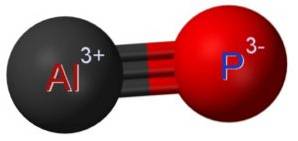
Strukturera
Aluminiumfosfiden AlP bildas genom föreningen av en aluminiumatom Al och en fosforatom P. Bindningen mellan båda är kovalent och trippel, därför är den mycket stark.
Aluminium i AlP har ett oxidationstillstånd på +3 och fosfor har en valens på -3.
Nomenklatur
- Aluminiumfosfid
Egenskaper
Fysiskt tillstånd
Mörkgrå eller mörkgul eller grön kristallin fast substans. Kubiska kristaller.
Molekylvikt
57,9553 g / mol
Smältpunkt
2550 ºC
Densitet
2,40 g / cm3 vid 25 ° C
Löslighet
Sönderdelas i vatten.
Kemiska egenskaper
Reagerar med fukt för att ge fosfin eller fosfan PH3 som är en brandfarlig och giftig förening. Fosfin eller fosfat antänds spontant vid kontakt med luft, utom om det finns överflödigt vatten.
Reaktionen av aluminiumfosfid med vatten är som följer:
Aluminiumfosfid + vatten → Aluminiumhydroxid + fosfin
AlP + 3HtvåO → Al (OH)3 + PH3↑
De kommersiella presentationerna har aluminiumkarbonat Altvå(CO3)3 för att förhindra fosfin självantändning som uppstår när AlP kommer i kontakt med fukt i luften.
AlP är stabil när den är torr. Reagerar våldsamt med syror och alkaliska lösningar.
Aluminiumfosfid AlP smälter inte, sublimer eller sönderdelas inte vid temperaturer så höga som 1000 ° C. Även vid denna temperatur är dess ångtryck mycket lågt, det vill säga det avdunstar inte vid den temperaturen..
Vid uppvärmning till nedbrytning avger den giftiga fosforoxider. I kontakt med metaller kan den avge brandfarliga vätgaser Htvå.
Andra egenskaper
När den är ren visar den en gulaktig färg, när den blandas med rester av beredningsreaktionen ger den en färg från grå till svart..
Dess låga flyktighet utesluter att den inte har någon lukt, så vitlökslukten som den ibland avger beror på fosfin PH3 som bildas i närvaro av fukt.
Erhållande
Aluminiumfosfid kan erhållas genom uppvärmning av en blandning av pulveriserad aluminiummetall (Al) och det röda fosforelementet (P).
På grund av affiniteten av fosfor (P) för syre (Otvåoch aluminium (Al) med syre och kväve (NtvåReaktionen måste utföras i en atmosfär fri från dessa gaser, till exempel i en atmosfär av väte (Htvå) eller naturgas.
Reaktionen startas genom att snabbt uppvärma en zon av blandningen tills reaktionen startar, vilken är exoterm (värme produceras under reaktionen). Från det ögonblicket fortsätter reaktionen snabbt.
Aluminium + fosfor → Aluminiumfosfid
4 Al + P4 → 4 AlP
Applikationer
Vid eliminering av skadedjur (avbruten användning)
Aluminiumfosfid användes tidigare som insektsmedel och som gnagare. Men även om det har förbjudits på grund av dess toxicitet används det fortfarande i vissa delar av världen..
Den används för rökning i slutna utrymmen där det finns bearbetade eller obearbetade jordbruksprodukter (t.ex. spannmål), djurfoder och icke-livsmedelsprodukter.
Målet är att kontrollera insekter och gnagare som attackerar lagrade föremål, oavsett om de är ätliga eller inte..
Det gör det möjligt att kontrollera gnagare och insekter i icke-tama, jordbruks- eller icke-jordbruksområden, sprutning utomhus eller i deras hål och bon för att förhindra att de smittar vissa sjukdomar.


Dess användningsform består av att utsätta AlP för luft eller fukt, eftersom fosfin eller fosfan PH frigörs.3 som skadar många organ i skadedjuret som ska elimineras.

I andra applikationer
Aluminiumfosfid AlP används som en källa för fosfin eller fosfan PH3 och används i halvledarforskning.
Teoretisk undersökning av AlP-nanorör
Teoretiska studier har utförts på bildandet av aluminiumfosfid AlP-nanorör. Nanorör är mycket små och mycket tunna cylindrar som endast kan synas med ett elektronmikroskop..
AlP-nanorör med bor
Teoretiska studier utförda genom beräkningsberäkningar visar att de föroreningar som kan tillsättas AlP-nanorören kan ändra de teoretiska egenskaperna hos dessa.
Till exempel uppskattas att tillsats av bor (B) -atomer till AlP-nanorör kan göra dem till halvledartyp-sid. En halvledare är ett material som beter sig som en ledare för elektricitet eller som en isolator beroende på det elektriska fält som den utsätts för.
Och en halvledartyp-sid Detta är när föroreningar läggs till materialet, i detta fall är AlP utgångsmaterialet och boratomerna skulle vara föroreningarna. Halvledare är användbara för elektronikapplikationer.
AlP-nanorör med förändrad struktur
Vissa forskare har utfört beräkningar för att bestämma effekten av att ändra kristallgitterstrukturen hos AlP-nanorör från sexkantiga till oktaedriska..
De fann att manipulation av gitterstrukturen kunde användas för att finjustera konduktiviteten och reaktiviteten hos AlP-nanorör och utforma dem för att vara användbara för elektronik- och optikapplikationer..
Risker
Kontakt med aluminiumfosfid kan irritera hud, ögon och slemhinnor. Vid förtäring eller inandning är det giftigt. Kan absorberas genom huden med toxiska effekter.
Om AlP kommer i kontakt med vatten reagerar det och bildar fosfin eller fosfan PH3 som är extremt brandfarligt då det antänds vid kontakt med luft. Därför kan det explodera. Dessutom orsakar fosfin människors och djurs död.
Eftersom aluminiumfosfid är ett billigt bekämpningsmedel är dess användning en vanlig orsak till förgiftning hos människor och har en hög dödlighet..

Det reagerar med luftfuktigheten i slemhinnorna och med saltsyran HCl i magen och bildar den mycket giftiga fosfangasen PH3. Därför bildas fosfin genom inandning och intag i kroppen med dödliga effekter..
Dess intag orsakar blödning i mag-tarmkanalen, kardiovaskulär kollaps, neuropsykiatriska störningar, andnings- och njursvikt inom några timmar..
AlP är mycket giftigt för alla mark- och vattenlevande djur.
Referenser
- USA National Library of Medicine. (2019). Aluminiumfosfid. Återställd från pubchem.ncbi.nlm.nih.gov.
- Sjögren, B. et al. (2007). Aluminium. Andra aluminiumföreningar. I Handbook on the Toxicology of Metals (tredje upplagan). Återställd från sciencedirect.com.
- Gupta, R.C. och Crissman, J.W. (2013). Säkerhetsbedömning inklusive aktuella och framväxande frågor inom toxikologipatologi. Mänsklig risk. I Haschek och Rousseauxs Handbook of Toxicology Pathology (tredje upplagan). Återställd från sciencedirect.com.
- White, W.E. och Bushey, A.H. (1944). Aluminiumfosfid - Beredning och sammansättning. Journal of The American Chemical Society 1944, 66, 10, 1666-1672. Återställd från pubs.acs.org.
- Mirzaei, Maryam och Mirzaei, Mahmoud. (2011). En teoretisk studie av bor-dopade aluminiumfosfid nanorör. Beräknings- och teoretisk kemi 963 (2011) 294-297. Återställd från sciencedirect.com.
- Takahashi, L. och Takahashi, K. (2018). Ställa in den elektroniska strukturen hos ett aluminiumfosfidrör genom konfiguration av gittergeometrin. ACS Appl. Nano Mater. 2018, 1, 501-504. Återställd från pubs.acs.org.
- Gupta, P.K. (2016). Toxiska effekter av bekämpningsmedel (jordbrukskemikalier). Aluminiumfosfid. I grundläggande ämnen för toxikologi. Återställd från sciencedirect.com.



Ingen har kommenterat den här artikeln än.