
Kondenserad formel vad det är och exempel (metan, etan, glukos ...)
De kondenserad formel det är en rent textuell representation av en molekyl där länkarna utelämnas. Dess syfte är att låta veta vad som är atomernas ordning. I allmänhet har linjära eller grenade molekyler kondenserade formler, förutom cykliska eller de som är starkt grenade..
I organisk kemi råder ofta förvirring om vad som är skillnaden mellan denna formel och den molekylära. I själva verket är det vanligt att hitta dem som synonymer. Under tiden används i oorganisk kemi mer molekylära formler, eftersom de i de flesta fall exakt beskriver kovalenta föreningar; som vatten, HtvåELLER.
Artikelindex
- 1 Vad är den kondenserade formeln?
- 2 Exempel
- 2.1 Metan
- 2.2 Etan
- 2.3 Glukos och fruktos
- 2.4 Butan
- 2,5 Etanol
- 2.6 Pentan
- 2.7 oktan
- 2.8 Cyklohexan
- 2.9 Aceton
- 2.10 ättiksyra
- 3 Allmän kommentar
- 4 Referenser
Vad är den kondenserade formeln?
För att definiera det mer bekvämt är den kondenserade formeln en förenklad representation av den halvutvidgade. Det är inte nödvändigt att skriva enstaka länkar, och det behöver inte spänna över mer än en rad i en text. Exempelvis kan 2-metylheptan, en grenad alkan, representeras i samma linje som i bilden ovan.
Kondenserade formler är användbara för att representera vissa molekyler utan att behöva rita dem. Detta är utmärkt när man skriver kemiska ekvationer där högförgrenade eller cykliska molekyler inte är inblandade. Det kommer att framgå att dessa formler använder parenteser för att ytterligare förenkla representationen av en molekyl.
Exempel
Metan
Metan är den enda kemiska föreningen som har en enda formel: CH4. Detta motsvarar det empiriska, molekylära, kondenserade och halvutvecklade samtidigt. För att undvika förvirring mellan alla dessa begrepp föredrar människor många gånger att hänvisa enkelt och exakt till den 'kemiska formeln' för en förening..
Etan
Etan har molekylformeln CtvåH6. Den kondenserade formeln är istället CH3CH3. Observera att C-C-bindningen och C-H-obligationerna utelämnas. Tanken är att kunna skriva formeln som om det vore ett ”ord” utan att behöva rita linjer eller rita strukturer.
Per definition är molekylformeln CtvåH6 och inte CH3CH3; För enkla molekyler används emellertid båda formlerna för att utbyta, även om det fortfarande är felaktigt. Detta är en skillnad mellan olika källor, där det tydligen inte finns några specifika regler i detta avseende..
Glukos och fruktos
Här är ett exempel där ett fel omedelbart observeras när man vill byta molekylformel mot den kondenserade.
Det söta paret, glukos och fruktos, har samma molekylformel: C6H12ELLER6, och därför tjänar detta inte till att differentiera dem. Däremot fastställer de strukturella och halvutvecklade formlerna visuellt att de är olika molekyler.
Emellertid har varken glukos eller fruktos en kondenserad formel. Detta beror på att oavsett vad deras representation eller projektion är, kan deras strukturer inte skrivas på samma rad; eller åtminstone på ett sätt som är trevligt och enkelt i läsarens ögon.
Butan
Butan har molekylformeln C4H10. Den har två isomerer: linjär, n-butan och den grenade, 2-metylpropan. Båda kan representeras av sina kondenserade formler. De n-butan är CH3CHtvåCHtvåCH3 eller CH3(CHtvå)tvåCH3, och 2-metylpropan är CH3CH (CH3)två eller (CH3)3CH.
I 2-metylpropan har vi en CH-grupp omgiven av tre CH3. Dess två formler är giltiga och parenteser används för att markera grenarna, prenumerationen är en indikator på hur många grupper som utgör nämnda gren.
Etanol
Etanol har den kondenserade formeln CH3CHtvåÅH. Lägg märke till hur nära den liknar sin halvutvecklade formel: CH3-CHtvå-ÅH. Samma görs med propanol, CH3CHtvåCHtvåÅh n-butanol, CH3CHtvåCHtvåCHtvåOH, och med alla andra alkoholer.
Om de har en gren, kommer det att anges inom en parentes till höger om atomen till vilken den är kopplad. Till exempel kan 2-metylbutanol skrivas som: CH3CHtvåCH (CH3) CHtvåÅH. Observera att för många molekyler blir det mer bekvämt att tillgripa en strukturell eller halvutvecklad formel.
Pentan
Den linjära isomeren av pentan, n-pentan, är det lätt att representera med sin kondenserade formel: CH3CHtvåCHtvåCHtvåCH3. Denna formel kan också förenklas med parenteser: CH3(CHtvå)3CH3, vilket indikerar att mellan de två CH3 det finns tre CHtvå.
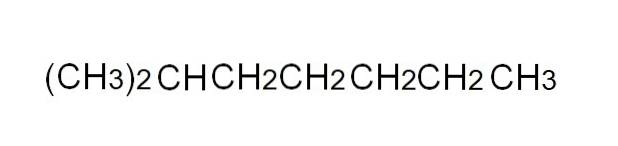
De andra två isomererna av pentan är dock lite mer komplicerade: CH3CHtvåCH (CH3)två, för 2-metylbutan och C (CH3)4 för 2,2-dimetylpropan eller neopentan. Observera att kolatomen till vänster om parentesen är den som bildar bindningar med substituenterna eller grenarna..
Oktan
Den linjära isomeren av oktan, n-oktan, på grund av dess längd, är det nu lämpligt att representera dess kondenserade formel som CH3(CHtvå)6CH3. Det är vid denna tidpunkt som något bör vara tydligt med kondenserade formler: de försöker spara tid när de representerar molekyler eller föreningar, utan att behöva skriva så mycket på papper.
Cyklohexan
Fallet med cyklohexan liknar glukos och fruktos: det saknar formellt en kondenserad formel eftersom det är en cyklisk förening. Ett sätt att försöka representera det skulle vara: (CHtvå)6, vilket antyder att sex CH-gruppertvå måste länkas, det är bara möjligt om de är stängda i en sexkantig ring. Det är dock bättre att dra ringen.
Aceton
Aceton har den egenskapen att ha en karbonylgrupp, C = O. För att skriva sin kondenserade formel har vi därför tre alternativ: (CH3)tvåCO, CH3C (O) CH3 eller CH3(C = O) CH3.
I större molekyler representeras faktiskt karbonylgruppen vanligtvis som (O), med hänsyn till att kolatomen till vänster är den som bildar dubbelbindningen med syre, C = O.
Ättiksyra
Den kondenserade formeln för ättiksyra är CH3COOH eller CH3COtvåH. En viktig punkt framträder här: funktionella grupper skrivna på samma rad är delar av en kondenserad formel. Detta var fallet med etanol och aceton och gäller även tioler (-SH), aldehyder (-CHO), estrar (-COtvåR eller -COOR) och aminer (-NHtvå).
Generell kommentar
Det finns mycket förvirring mellan molekylära och kondenserade formler. Kanske beror det på att dessa representationer ensamma redan ger en grov bild av molekylen, varför vi tror att det är molekylformeln.
På samma sätt har formler som C6H12ELLER6 de betraktas också som kondenserade, för i dem är det förenklat, molekylen "kondenseras" till atomer och prenumerationer. Det är därför det är vanligt att se hur de två formlerna nämns som om de vore synonymer.
I många källor, inklusive Wikipedia-artiklar, används termerna "kemisk formel" för molekylär (typ C6H12ELLER6 och andra) och "formel" för att referera till det kondenserade.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Helmenstine, Anne Marie, Ph.D. (18 november 2019). Kondenserad formeldefinition i kemi. Återställd från: thoughtco.com
- James Ashenhurst. (11 december 2019). Kondenserade formler: dechiffrera vad parenteserna betyder. Master organisk kemi. Återställd från: masterorganicchemistry.com
- Samarbete. (02 maj 2016). Empirisk, strukturell och kondenserad formel. Återställd från: quimiotecablog.wordpress.com
- Introduktion till kemi: allmänt, organiskt och biologiskt. (s.f.). Kondenserade struktur- och linjevinkelformler. Återställd från: 2012books.lardbucket.org



Ingen har kommenterat den här artikeln än.